微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在无土栽培中,需配制一定量含50mol NH4Cl、16mol KCl和24mol K2SO4的营养液。若用KCl、NH4Cl和
(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
[? ]
A.2、64、24
B.64、2、24
C.32、50、12
D.16、50、24
参考答案:B
本题解析:
本题难度:简单
2、填空题 (1)①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为?。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为?。
(2)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为?;
②所得溶液中Cl-的物质的量为?mol。
参考答案:(1)①32 g·mol-1 ②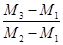 ×29
×29
(2)①10.7% ②0.25
本题解析:(1)①1个RO42-中核外电子总数比质子总数多2个,则0.5 mol RO42-核外电子总数比质子总数多1 mol,则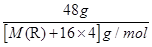 =0.5 mol M(R)=32 g·mol-1。
=0.5 mol M(R)=32 g·mol-1。
②由题意知,该瓶中空气质量为(M2-M1)g,气体A的质量为(M3-M1)g,由阿伏加德罗定律知,两气体的物质的量相等,即
 =
=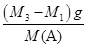
M(A)=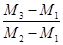 ×29。
×29。
(2)①根据c=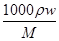 ,得w=
,得w=
= ×100%≈10.7%
×100%≈10.7%
②根据钠原子守恒可知n(NaCl)+n(NaClO)=n(NaOH)=0.100 L×3.00 mol·L-1=0.300 mol,则n(NaCl)=0.300 mol-0.050 0 mol=0.25 mol,则n(Cl-)=0.25 mol。
本题难度:一般
3、选择题 5g的钠、镁、铝、铁分别与1mol/L的盐酸100mL反应,产生气体的体积:
A.铝最多
B.钠最多
C.一样多
D.无法判断
参考答案:B
本题解析:盐酸的物质的量=1mol/L×0.1L=0.1mol,根据反应的方程式可知:
2Na+2HCl=2NaCl+H2↑
46g? 2mol? 1mol
2.3g? 0.1? 0.05mol
Mg+2HCl=MgCl2+H2↑
24g 2mol? 1mol
1.2g 0.1mol? 0.05mol
2Al+6HCl=2AlCl3+3H2↑
54g? 6mol? 3mol
0.9g 0.1mol? 0.05mol
这说明在反应中金属是过量的,但钠是活泼的金属,过量的钠继续与水反应放出氢气,因此最终是钠产生的氢气最多,镁和铝产生的氢气相同,答案选B。
本题难度:一般
4、计算题 某温度下,22%NaNO3溶液150mL,加100g水稀释后质量分数变为14%,求原NaNO3溶液的物质的量浓度。 (结果保留两位小数)
参考答案:3.02mol/L
本题解析:
本题难度:一般
5、填空题 (9分)取50.0mL K2CO3和K2SO4的混合溶液,加入过量BaCl2溶液后得到12.18g白色沉淀,用过量稀硝酸处理后沉淀量减少到2.33g,并有气体放出。试计算:
(1)原混合溶液中c(K2CO3) = ;c(K2SO4) = ;
(2)产生的气体在标准状况下的体积为 。
参考答案:(9分)(1)C(K2CO3) = 1mol/L;C(K2SO4) = 0.2mol/L
(2)1.12L
本题解析:(1)K2CO3和K2SO4的混合溶液与过量BaCl2溶液反应生成碳酸钡沉淀和硫酸钡沉淀共12.18g,加入过量硝酸,则碳酸钡溶于硝酸,硫酸钡不溶于硝酸,所以剩余沉淀是硫酸钡,质量是2.33g,所以碳酸钡的质量是12.18g-2.33g=9.85g,根据元素守恒,所以n(K2SO4)=n(BaSO4)=2.33g/233g/mol=0.01mol,所以c(K2SO4) =n(K2SO4)/0.05L=0.2mol/L;n(K2CO3) = n(BaCO3) =9.85g/197g/mol=0.05mol,c(K2CO3) =0.05mol/0.05L=1mol/L;
(2)碳酸钡与硝酸反应生成二氧化碳气体,根据C元素守恒可列关系式BaCO3~CO2,可知生成二氧化碳的物质的量是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。
考点:考查化学反应中物质的物质的量浓度、气体体积的计算
本题难度:一般