微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)A、B、C、D、E可能是NH4Cl、Ba(OH)2、KCl、K2SO4、(NH4)2SO4无色溶液中的一种,将它们两两混合时产生的现象是:
①A和B混合后产生白色沉淀,加热后无明显现象。
②B和C混合也产生白色沉淀,加热后有气体产生,气体使湿润的红色石蕊试纸变蓝。
③B和E混合后无沉淀,但加热后也产生使湿润的红色石蕊试纸变蓝的气体。
④D和任何一种溶液混合后,都无明显变化。根据上述现象,回答下列问题:
(1)A是___?_,? B是?___,C是_____?___,D是___?_____,E的电子式_____?__。
(2)写出有关反应的离子方程式:
A+B:________________________________________________;
B+C:_________________________________________________;
B+E:_____________________________________________。
参考答案:(1)K2SO4? Ba(OH)2? (NH4)2SO4? KCl?
(2)SO42- + Ba2+=BaSO4↓? Ba2++ 2OH- + 2NH4+ + SO42-=BaSO4↓? + 2NH3↑+ 2H2O
NH4+ + OH-=NH3↑+H2O
本题解析:根据①可知,生成的白色沉淀是硫酸钡,且反应中没有氨气生成,所以AB应该是氢氧化钡和硫酸钾。根据②可知,生成的白色沉淀是硫酸钡,且反应中有氨气生成,所以B是氢氧化钡,C是硫酸铵,则A就是硫酸钾。根据③可知,生成的气体是氨气,所以E是氯化铵,则D就是氯化钾。
点评:该题是中等难度试题的考查,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范答题能力。该类试题需要注意的是在进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
2、选择题 可以用分液漏斗分离的混合液是( )
A.乙酸乙酯和水
B.四氯化碳和溴
C.苯和苯酚
D.乙醇和乙酸
参考答案:A
本题解析:
本题难度:简单
3、选择题 某有色气体可能含NO2、CH4、CO2、HCl、NH3、Br2(g)等气体中的一种或几种,为确定其组成,进行以下操作:①通少许于水中,得无色溶液;②通少许于AgNO3溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶,导出的气体再通人澄清石灰水,产生浑浊。则可判断
A.一定存在NO2、Br2、HCl
B.一定不存在Br2、NH3、CH4
C.一定存在NO2、HCl、CO2
D.可能存在NH3、CH4
参考答案:C
本题解析:由①可判断,一定存在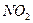 ;一定不存在
;一定不存在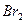 。由②可判断,一定存在HCl;一定不存在
。由②可判断,一定存在HCl;一定不存在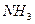 。由③、④可判断,一定存在HCI、
。由③、④可判断,一定存在HCI、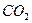 ;可能存在的是
;可能存在的是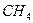 。
。
本题难度:一般
4、填空题 为了除去NaCl溶液中少量的MgCl2、Na2SO4,从稀盐酸,Na2CO3,K2CO3,Ba(NO3)2,Ba(OH)2溶液中,选择A、B、C?3种试剂,按图中步骤进行操作:
溶液
滤液滤液较纯净的NaCl溶液
(1)下列试剂的化学式A______?C______
(2)加入过量A的原因是______,有关反应的离子方程式是______,
______
(3)加入过量B有关反应的离子方程式是______.
参考答案:(1)除去NaCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2可加入所选试剂中的Na2CO3而除去;最后通过滴加盐酸可把过量的Na2CO3及反应生成的NaOH同时反应掉而生成NaCl;分析判断A为Ba(OH)2;C为HCl;
故答案为:Ba(OH)2;HCl;
(2)为确保混合溶液中的MgCl2和MgSO4全部反应而沉淀掉,应加入过量的Ba(OH)2,生成Mg(OH)2、BaSO4;反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓?Ba2++SO42-=BaSO4↓;
故答案为:为了除尽Mg2+和SO42-;Mg2++2OH-=Mg(OH)2↓?Ba2++SO42-=BaSO4↓;
(3)为确保溶液是的Ba2+全部沉淀而除去,应加入过量的Na2CO3到沉淀不再产生;反应生成碳酸钡沉淀、氯化钠、氢氧化钠;反应的离子方程式为:Ba2++CO32-=BaCO3↓;
故答案为:Ba2++CO32-=BaCO3↓;
本题解析:
本题难度:简单
5、选择题 下列有关实验结论正确的是
A.某单质的水溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
B.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42-离子
C.向某固体中滴加稀盐酸,产生能使澄清石灰水变浑浊、但不能使品红溶液褪色的气体,则原固体中一定含有CO32-或HCO3-离子
D.为测定2SO2+O2 2SO3反应混合物中硫元素的总量,将其加入到足量硫酸酸化的高锰酸钾溶液中,再加足量BaCl2溶液,过滤、洗涤、干燥、称量、计算即可
2SO3反应混合物中硫元素的总量,将其加入到足量硫酸酸化的高锰酸钾溶液中,再加足量BaCl2溶液,过滤、洗涤、干燥、称量、计算即可
参考答案:
本题解析:A选项,错误,该溶液有可能为碘水。B选项,错误,不能排除原溶液中含有银离子。C选项正确。D选项,错误,由于加入到足量硫酸酸化的高锰酸钾溶液中,溶液中含有硫酸根,硫元素总量增加。
本题难度:一般