微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2一具有相同的电子层结构,离子半径:Z2->W一;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是? (? )
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,w的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
2、选择题 下列表达式错误的是( )
A.甲烷的电子式: 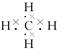
B.氮原子的L层电子排布图: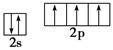
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳12原子: 612C
3、简答题 (12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。
4、填空题 X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2
|
Y
| 地壳中含量最高的元素
|
Z
| 存在质量数为23,中子数为11的核素
|
W
| 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质
|
R
| 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
|
?
(1)W在元素周期表中的位置为?;X、Y、Z、W四种元素的原子半径从大到小的顺序是?(用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为?;B的电子式为?。化合物ZY中存在的化学键类型为?。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为?,其最高价氧化物对应的水化物的化学式为?。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是?(用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为?。检验溶液中R3+常用的试剂是?,可以观察到的现象是?。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为?。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为?。
5、实验题 (13分) 现有短周期元素X形成的单质A与NaOH溶液反应,
有如下 转化关系:
转化关系: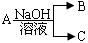 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为?,实验室制备A的化学方程式为?;
(2)若常温常压下,A为非金属固态单质 ,且其在电子工业中有着重要的用途,则工业制取A化学方程式为?;
,且其在电子工业中有着重要的用途,则工业制取A化学方程式为?;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为?
?;其最高氧化物与NaOH溶液反应的离子方程式为?;
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
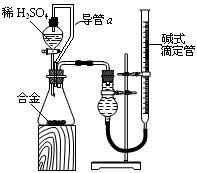
①装置中导管a的作用是? ?;
?;
②实验中准确测得4个数据:实验前该合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL;则通常状况时气体摩尔体积Vm=____________L·moL-1。