微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为:xMg+Mo3S4
MgxMo3S4;在镁原电池放电时,下列说法错误的是( )
A.发生氧化反应:Mo3S4
B.正极反应为:Mo3S4+2xe-═Mo3S42x-
C.向负极迁移:Mg2+
D.负极反应为:xMg-2xe-═xMg2+
参考答案:A、放电时,相当于原电池原理,金属镁化合价升高,是金属镁发生氧化反应;
B、原电池工作时,正极发生得电子的还原反应,即:Mo3S4+2xe-=Mo3S42x-,故B正确;
C、原电池工作时,电解质中的阴离子向负极移动,电池内部Mg2+向正极移动,故C错误;
D、原电池工作时,负极镁发生失电子的氧化反应,即xMg-2xe-═xMg2+,故D正确.
故选AC.
本题解析:
本题难度:简单
2、选择题 锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为:V2O5+xLi→LixV2O5,下列说法不正确的是
A.向外供电时,锂离子向负极移动
B.负极上反应的物质是锂,正极上反应的物质是V2O5
C.正极的电极反应为:V2O5+xe-+xLi+→LixV2O5
D.负极的电极反应为:xLi-xe-→ xLi+
参考答案:A
本题解析:反应中V由+5价降为 价,Li由0价升为+1价,负极上反应的物质是Li,正极上反应的物质是V2O5,B正确;负极反应为Li-e-=Li+,D正确;正极反应为V2O5+xe-+xLi+=LixV2O5,C正确;原电池内部阳离子向正极迁移、阴离子向负极迁移,A错误。
价,Li由0价升为+1价,负极上反应的物质是Li,正极上反应的物质是V2O5,B正确;负极反应为Li-e-=Li+,D正确;正极反应为V2O5+xe-+xLi+=LixV2O5,C正确;原电池内部阳离子向正极迁移、阴离子向负极迁移,A错误。
点评:原电池中负极失电子、正极得电子;原电池内部阳离子向正极迁移、阴离子向负极迁移。
本题难度:简单
3、选择题 天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
参考答案:A、充电时,电池的负极和阴极相连,发生得电子的还原反应,故A错误;
B、放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,故B正确;
C、由于单质锂较活泼,易与醇以及羧酸类物质反应而变质,电解质不能含有醇和羧酸,故C错误.
D、锂离子电池的比能量高,故D错误.
故选B.
本题解析:
本题难度:简单
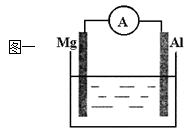
4、填空题 (8分)根据原电池的知识回答下列问题
(1)图一烧杯中溶液为稀硫酸,则观察到Al上的现象是
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应为: 。
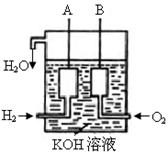
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为: 。
(4)铅蓄电池放电时反应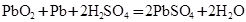 ,若放电消耗2mol硫酸时电路中转移电子_________mol
,若放电消耗2mol硫酸时电路中转移电子_________mol
参考答案:(1)产生大量气泡 (2)O2+2H2O+4e-=4OH-
(3)CH4+10OH-—8e-=CO32-+7H2O (4)2mol (1分)
本题解析:(1)在原电池中较活泼的金属作负极,不活泼的金属(非金属)作正极。因为镁的活泼性强于Al的,所以若用稀硫酸作电解质溶液,则镁是负极,铝是正极,溶液中的氢离子在正极上得到电子,被还原生成氢气。
(2)在燃料电池中,氧气得到电子,所以氢气等燃料在负极通入,氧气(或空气)在正极通入,因此正极反应式为O2+2H2O+4e-=4OH-。
(3)甲烷在反应中失去电子,被氧化生成CO2和水,但电解质是氢氧化钾溶液,所以生成的CO2被吸收,生成碳酸钾。所以负极的电极反应式为CH4+10OH-—8e-=CO32-+7H2O。
(4)根据总反应式可判断,铅是还原剂,化合价有0价升高到+2价,失去2个电子,所以每消耗2mol硫酸,反应中转移的电子是2mol。
本题难度:一般
5、填空题 新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶?凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4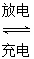 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。
参考答案:(1)防止Fe2+被氧化成Fe3+ (2)用一束强光照射溶液,从侧面能观察到一条光亮的通路 1 (3)嵌有Li的石墨 Li2FeSiO4-e-=LiFeSiO4+Li+ (4)充电
本题解析:(1)Fe2+易被氧化成Fe3+,加热时需隔绝空气。(2)胶体的特性是丁达尔效应。根据Fe(NO3)3~e-~Li2FeSiO4,生成1 mol Li2FeSiO4转移1 mol电子。(3)负极失电子发生氧化反应,应是嵌有Li的石墨作负极。Li2FeSiO4在阳极失电子发生氧化反应。(4)该电池组装后没有LiFeSiO4,所以不能放电,充电后产生LiFeSiO4才可以放电。
本题难度:一般