微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体溶于水时,发生了氧化还原反应的是?
A.SO3溶于水
B.NH3溶于水
C.CO2溶于水
D.NO2溶于水
参考答案:D
本题解析:氧化还原反应的本质是电子的转移,而表现在化合价的变化上,因此凡有元素化合价升降的反应都是氧化还原反应。因此选项ABC中元素的化合价都没有变化,不是氧化还原反应 。,NO2溶于水生成硝酸和NO,其中氮元素的化合价部分升高到+5价,部分降低到+2价,属于氧化还原反应,且NO2既是氧化剂,还是还原剂。答案选D。
本题难度:简单
2、填空题 Ⅰ.过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
⑴写出H2O2的电子式_________________,其分子内存在______键和_______键。
⑵你认为H2O2被成为“绿色氧化剂”的主要原因是________________________________________。
⑶与H2O2分子具有相同电子数的双原子单质分子为(写化学式)______________,与H2O2分子具有相同电子数的三原子化合物分子为(写化学式)______________。
⑷某工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式为___________________________________________,反应中H2O2作_____________剂。
⑸将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为___________________________________________,反应中H2O2作_____________剂。
⑹双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
MnO4-+?H2O2+?H+===?Mn2++?H2O+?。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
⑴该反应的化学方程式为_____________________________________________。
⑵如反应转移了0.3mol电子,则产生的气体在标准状况下体积为?
参考答案:Ⅰ.⑴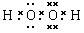 ,极性键?非极性键?⑵H2O2的还原产物为水,对环境无污染
,极性键?非极性键?⑵H2O2的还原产物为水,对环境无污染
⑶F2? H2S?⑷Cl2+H2O2=2HCl+O2↑?还原剂?
⑸2Fe2++H2O2+2H+=2Fe3++2H2O?氧化剂?⑹? 2? 5? 6 = 2? 8? 5O2↑
Ⅱ.⑴3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O?⑵3.36L
本题解析:Ⅰ.、(1)过氧化氢是含有极性键和非极性键的共价化合物,电子式是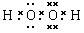 。
。
(2)由于H2O2的还原产物为水,对环境无污染,所以过氧化氢被称为绿色氧化剂。
(3)双氧水中含有18个电子,所以与H2O2分子具有相同电子数的双原子单质分子为F2,而与H2O2分子具有相同电子数的三原子化合物分子为H2S。
(4)氯气具有强氧化性,能把双氧水氧化生成氧气和水,反应的方程式是Cl2+H2O2=2HCl+O2↑。
(5)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。
(6)双氧水中氧元素的化合价从-1价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从+7价降低到+2价,得到2个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是2? 5? 6 = 2? 8? 5O2↑。
Ⅱ.、(1)双氧水生成氧气的过程是被氧化的过程,即双氧水作还原剂,所以铬酸是氧化剂,因此反应的方程式是3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O。
(2)根据方程式可知,反应中转移6个电子,所以如反应转移了0.3mol电子,则产生的气体是0.15mol,标准状况下的体积是0.15mol×22.4L/mol=3.36L。
本题难度:一般
3、选择题 用0.1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-3 mol的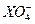 还原,则元素X在还原产物中的化合价是(?)
还原,则元素X在还原产物中的化合价是(?)
A.+1
B.+2
C.+3
D.+4
参考答案:D
本题解析:硫元素化合价升高的总数等于X元素化合价降低的总数,则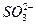 中
中 ,
,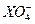 中
中
0.1×30×10-3×2=2×10-3×(7-a),a=4。
本题难度:简单
4、选择题 由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOC1?2在酸性条件下可以产生C12?,下列关于混盐CaOC12的有关判断不正确的是
A.该混盐与硫酸反应产生1molC12时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和-1
参考答案:A
本题解析:根据混盐的概念可知,混盐CaOC1?2中的酸根应该是ClO-和Cl-,所以该混盐与硫酸反应产生1molC12时转移NA个电子,选项A不正确,D正确;ClO-水解显碱性,B正确;次氯酸盐具有强氧化性,C正确,答案选A。
点评:本题关键是准确理解混盐的概念,然后根据化合价以及生成物氯气判断出盐中的酸根。
本题难度:一般
5、选择题 下列变化中,需加氧化剂才能实现的是
A.NaClO →NaCl
B.FeCl3 →FeCl2
C.C → CO2
D.CaO→Ca(OH)2
参考答案:C
本题解析:
正确答案:C
A.NaClO →NaCl ,Cl化合价降低,加还原剂? B.FeCl3 →FeCl2?铁化合价降低,加还原剂? C.C → CO2?化合价升高,加氧化剂? D.CaO→Ca(OH)2,元素化合价均不变,需要加氧化剂、还原剂。
本题难度:简单