| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学基本概念》高频考点强化练习(2017年最新版)(四)
F.氧气和臭氧 G. 13C和14C H.CH3OCH3和CH3CH2OH ⑶亚硫酸钠和碘酸钾在酸性溶液中发生以下反应: Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O (a)配平上面的氧化还原反应方程式,将系数填入方框中。 (b)其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。 参考答案:(13分)(1) 本题解析:(2)考查了各概念之间的差别。中子数不同、质子数相同的原子互称为同位素;同种元素不同单质互称为同素异形体,分子式相同的不同物质互称为同分异构体; 本题难度:一般 3、选择题 在氧化还原反应中,水作为氧化剂的是( ) |
参考答案:A
本题解析:略
本题难度:一般
4、选择题 在下列物质中,分别加入金属钠,不能产生氢气的是
A.无水酒精
B.蒸馏水
C.苯
D.乙酸
参考答案:C
本题解析:分析:根据能跟钠反应的有机物有羧酸、醇、酚、水、酸等.
解答:A、无水酒精能与钠反应,羟基上的氢原子被还原,生成乙醇钠和氢气,故A错误;
B、水与钠反应生成氢氧化钠和氢气,故C错误;
C、苯与钠不反应,故C正确;
D、乙酸能与钠反应,羧基中的氢原子被还原,生成乙酸钠和氢气,故D错误;
故选:C.
点评:本题考查苯、乙醇、乙酸的性质等,难度较小,以识记为主,根据所学知识来解答.
本题难度:一般
5、选择题 将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
参考答案:C
本题解析:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误; B、根据方程式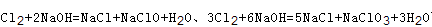 可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式
可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式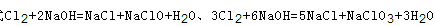 可知,氧化产物只有NaClO时,转移电子数最少,为
可知,氧化产物只有NaClO时,转移电子数最少,为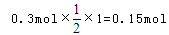 氧化产物只有NaClO3时,转移电子数最多,为
氧化产物只有NaClO3时,转移电子数最多,为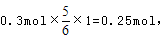 故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
考点:考查氧化还原反应计算、根据方程式的计算等相关知识点
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《氧化还原反.. | |