微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.碱性溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
参考答案:A、因含有大量Al3+的溶液显酸性,且该组离子之间不发生反应,则能够大量共存,故A正确;
B、因碱性溶液中Ca2+与CO32-结合生成碳酸钙沉淀,Ca2+、SO42-结合生成微溶物硫酸钙,则不能大量共存,故B错误;
C、因Fe3+与SCN-结合生成络离子,则不能大量共存,故C错误;
D、因NO3-与H+、Fe2+发生氧化还原反应,则该组离子不能大量共存,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 有50 mL 0.2 mol·L-1的氨水溶液,欲使溶液的pH变小,可采用的方法是(?)
A.加少量NaOH
B.加100 mL 水
C.加10 mL 0.4 mol·L-1的氨水
D.加少量Na2CO3溶液
参考答案:B
本题解析:加NaOH(强碱)和浓度更大些的氨水,pH会升高,Na2CO3溶液呈碱性,也会导致pH升高。
本题难度:简单
3、选择题 下列描述正确的是
A.在pH=1溶液中,NH4+、K+、ClO—、Cl—可以大量共存
B.MgO可以除去MgCl2溶液中的FeCl3
C.足量铁粉与稀硝酸反应:Fe + 4H+ +NO3—== Fe3+ + 2H2O + NO ↑
D.对于平衡体系:H2(g)+I2(g)  2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深
2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深
参考答案:B
本题解析:A中溶液显酸性,ClO—不能大量共存;C中铁过量,应该生成亚铁离子,C不正确;D中反应前后体积不变,改变压强平衡不移动,D不正确,因此正确的答案选B。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题考查的知识点比较分散,但很基础,学生不难得分。
本题难度:简单
4、选择题 常温下,pH=3的一元酸和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应。下列说法不正确的是
A.两溶液混合反应后的所得的混合溶液呈碱性
B.所用酸溶液的浓度大于所用氢氧化钠溶液的浓度
C.若酸为醋酸,原醋酸溶液中有1%的醋酸已电离
D.若酸为醋酸,反应后的溶液中CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1
参考答案:B
本题解析:A、酸为弱酸,混合后生成强碱弱酸盐,水解呈碱性;
B、恰好反应,说明酸和碱浓度相等;
C、酸的浓度为0.1mol/L;氢离子为0.001mol/L;故有1%电离;
D、根据物料守恒可以得到
本题难度:一般
5、填空题 X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
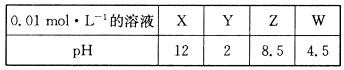
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。
参考答案:(1)NaOH;NH4NO3(2)NH4NO3=NH4++NO3-(3)NO2-+H2O HNO2+OH-
HNO2+OH-
(4)c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O
本题解析:(1)HNO3是强酸,0.01mol·L-1 HNO3溶液的pH为2,NH4NO3是强酸弱碱盐,NH4+不完全水解生成H+溶液显酸性pH小于7,NaOH为强碱,0.01mol·L-1NaOH溶液的pH为12,NaNO2是强碱弱酸盐溶液,NO2—在溶液中水解显碱性pH大于7,故X为NaOH,Y为HNO3,Z为NaNO2,W为 NH4NO3(2)NH4NO3在溶液中完全电离生成NH4+与NO3-,电离方程式:NH4NO3=NH4++NO3-(3)NO2-在溶液中水解生成HNO2与OH-,使溶液显碱性,离子方程式NO2-+H2O HNO2+OH-(4)由题意知,混合溶液中各离子的浓度大小顺序即为物质的量大小顺序,设每种溶液各1L,则在Na+溶液中完全电离物质的量为2mol,NO3-在溶液中完全电离物质的量为1mol,NaOH中OH-与HNO3中H+等物质的量完全反应,NO2-在溶液中部分水解产生OH-,混合溶液中H+由水电离,故浓度大小顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)(5)NaNO2溶液与NH4NO3溶液混合加热,产生一种无色无味的单质气体只可能为N2反应方程式:NaNO2+NH4NO3
HNO2+OH-(4)由题意知,混合溶液中各离子的浓度大小顺序即为物质的量大小顺序,设每种溶液各1L,则在Na+溶液中完全电离物质的量为2mol,NO3-在溶液中完全电离物质的量为1mol,NaOH中OH-与HNO3中H+等物质的量完全反应,NO2-在溶液中部分水解产生OH-,混合溶液中H+由水电离,故浓度大小顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)(5)NaNO2溶液与NH4NO3溶液混合加热,产生一种无色无味的单质气体只可能为N2反应方程式:NaNO2+NH4NO3 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O
本题难度:一般