微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O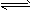 HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
[? ]
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度, 减小
减小
D.加入NaOH固体,溶液pH减小
参考答案:B
本题解析:
本题难度:一般
2、选择题 温室时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是(? ).
A.若pH>7时,则一定是c1v1=c2v2
B.在任何情况下都是c(Na+) + c(H+)=c(CH3COO-) + c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2, c1=c2,则c(CH3COO-) + c(CH3COOH)=c (Na+)
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列溶液中各微粒浓度关系判定不正确的是
A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1
B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-)
C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3)
参考答案:B
本题解析:A. n(Cl-)=c·V=0.1mol/L×0.01L=0.001mol.在反应的过程中没有消耗。反应后c(Cl-)="n/L" ="0.001mol" ÷0.02L="0.05mol/L." n(NH3)= c·V=0.1mol/L×0.02L=0.002mol.反应后 n(NH3) ="n/L=0.002mol" ÷0.02L=" 0.1" mol/L根据物料守恒可得c(NH3)= c(NH4+)+c(NH3·H2O)= 0.1mol/L="2" c(Cl-).正确。B. HF、CH3COOH都是弱酸,所以NaF与CH3COOK都是强碱弱酸盐。由于酸性HF > CH3COOH,所以根据盐的水解规律:有弱才水解,越弱越水解,谁强显谁性。水解程度CH3COO->F-。n(NaF)=n(CH3COOK).水解程度越大,剩余离子的浓度就越小。所以c(K+) ?—c(CH3COO-) >c(Na+) —c(F-)。错误。C. 在任何溶液中都存在着电荷守恒。即阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。可得c(Na+)+c(K+)+c(H+)=c(CH3COO-)+c(OH-)+ c(NO3-)。由于NaNO3是强酸强碱盐,在溶液中不水解,所以c(Na+)=c(NO3-)。两式相减可得:c(K+)+c(H+)=c(CH3COO-)+c(OH-)。正确。D. NaHSO3是强碱弱酸的酸式盐。在溶液中存在电离平衡HSO3-- H++ SO32--,和水解平衡:HSO3+H2O--
H++ SO32--,和水解平衡:HSO3+H2O-- OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
本题难度:一般
4、填空题 (18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5? Ca 40? O 16)
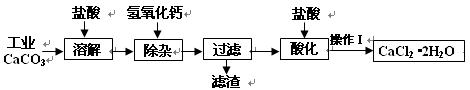
(1)CaCO3与盐酸反应的离子方程式??。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为??。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有?。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
①?,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括?、?、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L? AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 ?.(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为?。
参考答案:(18分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O(3分)
(2)①Al(OH)3、Fe(OH)3(2分),②普通漏斗(2分)
(3)除去过量的氢氧化钙(2分,合理则给分);
(4)(蒸发2分、结晶2分),(或写蒸发浓缩、降温结晶)
(5)① 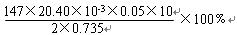 ?(3分)
?(3分)
②样品中存在少量的NaCl (2分,合理则给分如少量的CaCl2·2H2O失水等)
本题解析:略
本题难度:一般
5、选择题 常温下,下列有关叙述正确的是?(?)
A.0.1 mol·L-1醋酸溶液加水稀释后,各离子浓度均减小
B.pH=7的NH4Cl和氨水混合溶液中,c(NH+4)=c(Cl—)
C.加热滴有酚酞的CH3COONa溶液,溶液颜色变浅
D.0.1 mol·L-1 Na2CO3溶液中,c(HCO—3)>c(OH—)
参考答案:B
本题解析:略?常温下水、酸碱的稀溶液Kw值不变,醋酸加水稀释后,pH增大,c(H+)减小,c(OH-)增大,A错;根据电子守恒原理c(NH+4)+c(H+) c(Cl—)+c(OH-),pH=7时,c(H+)c(OH-),所以c(NH+4)=c(Cl—),B正确;加热醋酸根的水解平衡享有移动,c(OH-)增大,溶液颜色变深,C错误;0.1 mol·L-1 Na2CO3溶液中还存在平衡c(HCO—3)+H2O
c(Cl—)+c(OH-),pH=7时,c(H+)c(OH-),所以c(NH+4)=c(Cl—),B正确;加热醋酸根的水解平衡享有移动,c(OH-)增大,溶液颜色变深,C错误;0.1 mol·L-1 Na2CO3溶液中还存在平衡c(HCO—3)+H2O c(H2CO3)+c(OH-),c(HCO—3)< c(OH—),D 错误.
c(H2CO3)+c(OH-),c(HCO—3)< c(OH—),D 错误.
本题难度:一般