微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两种微粒的质子数和电子数均分别相等,它们不可能是
A.一种阳离子和一种阴离子
B.一种单质和一种化合物分子
C.一种分子和一种离子
D.一种原子和一种分子
参考答案:C
本题解析:略
本题难度:简单
2、选择题 有A、B和C三种主族元素,若A元素的阴离子与B、C元素的阳离子具有相同的电子层结构,且B的阳离子半径大于C的阳离子半径,则这三种元素的原子序数大小次序是( )
A.B<C<A? B.A<B<C
C.C<B<A? D.B>C>A
参考答案:B
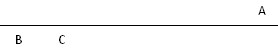
本题解析:重点考查了微粒半径的大小比较:首先是电子层数越大半径越大,如果层数相同则核电荷数越大半径越小。三元素在周期表中的位置关系如图所示:
本题难度:一般
3、选择题 五种短周期元素X、Y、Z、M、N的原子序数依次增大,X、Y、Z、M是组成蛋白质的基础元素,M原子的最外层电子数是电子层数的3倍,N2M2可用于潜水艇中作为氧气的来源,下列说法错误的是
A.与Y同主族的短周期元素可与强碱反应生成氢气
B.X和M形成的化合物分子中可能含有非极性共价键
C.由X、Z、M形成的化合物一定是共价化合物
D.等物质的量的N2YM3粉末和NXYM3粉末分别与等浓度的盐酸反应,后者反应速率要快
参考答案:C
本题解析:由题意可知X、Y、Z、M、N分别为H、C、N、O、Na。
A、与Y同主族短周期元素为Si,可以与强碱生成氢气,正确;B、X和M可形成H2O2,其中阴离子中含有非极性键,正确;C,X、Z、M可形成NH4NO3,是离子化合物,错误;D、等物质的量的NaCO3和NaHCO3,其中HCO3-更易结合H+,因此反应速率更快,正确。
本题难度:一般
4、选择题 下列说法中正确的是 (? )
A.CO2 分子的键角是180°,类推出CS2分子的键角也是180°
B.不能用电解熔融状态AlCl3制取铝,类推出也不能用电解熔融状态MgCl2制取镁
C.分子中只有共价键的化合物一定是共价化合物
D.三氟化硼(BF3)和六氟化氙(XeF6)分子中的所有原子都满足最外层8电子结构
参考答案:AC
本题解析:CO2 分子和CS2分子均是非极性分子,键角均为是180°,A正确。AlCl3是分子晶体,不能用电解熔融状态AlCl3制取铝,而MgCl2是离子晶体,能用电解熔融状态MgCl2制取镁,B错误。C正确。根据电子式可知,三氟化硼(BF3)和六氟化氙(XeF6)分子中B和Xe均不满足最外层8电子结构,D错误。
点评:本题综合考查物质的结构,分子键角,电解,共价化合物,电子结构等知识点,属于基础题,考生平时要注意积累,加强巩固。
本题难度:简单
5、简答题 (12分)A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大。A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y, 且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子, 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为?___________。
参考答案:(1)氮;N≡N (2)Na·+·H→Na+[:H]-
(3)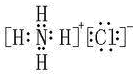 ;?
;?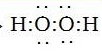 (4)Al(OH)3+OH-=AlO2-+2H2O
(4)Al(OH)3+OH-=AlO2-+2H2O
本题解析:根据题意可推知这几种元素分别是A是H;B是N;C是O;D是Na;E是Al;F是Cl。(1)B元素的名称是氮;B单质的结构式为N≡N。(2)用电子式表示化合物X的形成过程为Na·+·H→Na+[:H]-。(3)化合物NH4Cl的电子式为为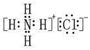 。Na2O2的电子式为
。Na2O2的电子式为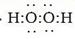 。(4)Na的最高价氧化物的水化物NaOH是强碱;、Al最高价氧化物的水化物Al(OH)3是两性氢氧化物,能跟强碱发生反应,生成盐和水。该反应的两种方程式为Al(OH)3+OH-=AlO2-+2H2O。
。(4)Na的最高价氧化物的水化物NaOH是强碱;、Al最高价氧化物的水化物Al(OH)3是两性氢氧化物,能跟强碱发生反应,生成盐和水。该反应的两种方程式为Al(OH)3+OH-=AlO2-+2H2O。
本题难度:一般