微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4 = Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是
[? ]
反应温度/℃ Na2S2O3溶液V/mL c/mol/L 稀H2SO4 V/mL c/mol/L H2O V/mL
A. 25 5 0.1 10 0.1 5
B. 25 5 0.2 5 0.2 10
C. 35 5 0.1 10 0.1 5
D. 35 5 0.2 5 0.2 10
2、选择题 对于反应2SO2(g)+O2(g)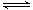 2SO3(g),能增大正反应速率的措施是(?)
2SO3(g),能增大正反应速率的措施是(?)
A.移去部分SO3
B.增大容器的体积
C.通入大量O2
D.升高体系温度
3、选择题 在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是? ( ? )
测定时刻/s
| t1
| t2
| t3
| t4
|
c(A)/(mol/L)
| 6
| 3
| 2
| 2
|
c(B)/(mol/L)
| 5
| 3.5
| 3
| 3
|
c(C)/(mol/L)
| 1
| 2.5
| 3
| 3
|
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol/(L·s)
4、选择题 反应4NH3+5O2 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为
A. (O2)=0.01 mol·L-1·s-1
(O2)=0.01 mol·L-1·s-1
B. (NO)=0.008 mol·L-1·s-1
(NO)=0.008 mol·L-1·s-1
C. (H2O)=0.003 mol·L-1·s-1
(H2O)=0.003 mol·L-1·s-1
D. (NH3)=0.002 mol·L-1·s-1
(NH3)=0.002 mol·L-1·s-1
5、简答题 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=a?kJ?mol-1的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 427 | 700 | 800
平衡常数
9.94
9
b
0.64
|
(1)a______0?(填“<”或“>”).若到达平衡后升高温度,则CO的转化率将______,正反应速率______(填“增大”、“减小”或“不变”).
(2)若在427℃时进行,且CO、H2O的起始浓度均为0.01mol/L,在该条件下,CO的最大转化率为______.
(3)700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
|
保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=______mol;b=______.