|
高考化学必考知识点《氯及其化合物》考点预测(2017年强化版)(二)
2017-08-08 06:51:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)?。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
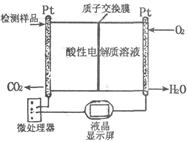
负极?,正极?。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是?。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO
| 当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为?;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为?。
参考答案:(1)CO(g)+2H2(g) CH3OH(g) CH3OH(g)
(2)负极:2CH3OH-12e-+2H2O?2CO2+12H+?正极:3O2+12e-+12H+?6H2O
(3) B 2.67(或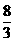 )?(4)1∶7 )?(4)1∶7
本题解析:(1)因为化学反应的过程就是原子重新组合的过程,由于“绿色化学”就是反应物的原子完全转化为目标生成物,所以使用CO、H2来制取CH3OH 。反应的方程式为:CO(g)+2H2(g)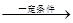 CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2 CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2 SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2 SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2 SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2 SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2 SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得 SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得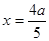 .所以在该温度下该反应平衡常数 .所以在该温度下该反应平衡常数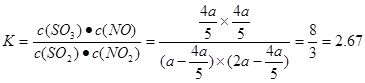 。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7. 。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
本题难度:困难
2、选择题 下列关于氯水的叙述,正确的是
[? ]
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后pH值将变小
参考答案:BD
本题解析:
本题难度:简单
3、选择题 下列物质中能跟水反应且没有气体生成的是(? )
A.Na2O2
B.Na
C.F2
D.Na2O
参考答案:D
本题解析:过氧化钠与水反应生成氢氧化钠与氧气,金属钠与水反应生成氢氧化钠和氢气,单
质氟与水反应生成氢氟酸和氧气,氧化钠与水反应只生成氢氧化钠。
本题难度:简单
4、填空题 (8分)实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
完成下列问题:
(1)该反应中氧化剂是_____________;还原产物是_____________。
(2)若反应中有0.5 mol电子转移,被氧化的HCl的物质的量是多少?有多少克KMnO4参加了反应?
参考答案:(1) KMnO4;MnCl2? (各1分)
(2) n(HCl)被氧化=0.5 mol? (3分)
m(KMnO4)=15.8 g? (3分)
本题解析:略
本题难度:简单
5、选择题 某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO-与ClO3-的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
参考答案:根据ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1.
故选:D.
本题解析:
本题难度:一般
|