| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《化学平衡》高频试题特训(2017年最新版)(二)
参考答案:A 本题解析:A、由H2、I2蒸气、HI组成的平衡体系,增加压强,体积变小,颜色变深,平衡不移动,故不能用勒夏特列原理解释,故A可选;B、2SO2+O2=2SO3,增大压强,平衡正向移动,故能用勒夏特列原理解释,故B不选;C、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,抑制了氯气的溶解,所以用排饱和食盐水的方法收集氯气,可以用平衡移动原理来解释,故C不选;D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来,降低生成物浓度,平衡正向移动,可以用平衡移动原理来解释,故D不选。 本题难度:一般 2、选择题 现有3个体积相等的密闭容器,都进行下列反应:CO2(g)+H2(g)?H2O(g)+CO(g),反应所处的温度相同,但起始浓度不同,其中甲:n(CO2)=n(H2)=1mol;乙:n(CO2)=1mol,n(H2)=2mol;丙:n(CO2)=n(H2)=1mol,n[H2,O(g)]=1mol.达到平衡时CO的物质的量由大到小的顺序是( ) 参考答案:对于乙到达平衡状态,可以等效为在甲到达平衡的基础上再加入1mol氢气,平衡向正反应移动,二氧化碳的转化率增大,平衡时乙中CO的物质的量比甲中CO的物质的量大, 本题解析: 本题难度:一般 3、选择题 温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1 mol O2发生反应; |
参考答案:A
本题解析:已知反应:2SO2+O2 2SO3,反应物的化学计量数之和大于生成物的化学计量数之和,随着反应的进行,气体的物质的量逐渐减小,如甲为恒温恒压条件,乙为恒温恒容条件,当同时开始反应都达平衡,甲的压强大于乙的压强,根据增大压强平衡向正反应方向移动可知,甲可看作在乙的基础上增大压强,则平衡向正反应方向移动,则乙中SO2的转化率较低,甲中SO2的转化率较高,A正确,B错误;C.混合气体的密度=m/V,甲中体积小,密度大,C错误;D.混合气体的平均相对分子质量=m/n,甲中n小,平均相对分子质量大,D错误,选A。
2SO3,反应物的化学计量数之和大于生成物的化学计量数之和,随着反应的进行,气体的物质的量逐渐减小,如甲为恒温恒压条件,乙为恒温恒容条件,当同时开始反应都达平衡,甲的压强大于乙的压强,根据增大压强平衡向正反应方向移动可知,甲可看作在乙的基础上增大压强,则平衡向正反应方向移动,则乙中SO2的转化率较低,甲中SO2的转化率较高,A正确,B错误;C.混合气体的密度=m/V,甲中体积小,密度大,C错误;D.混合气体的平均相对分子质量=m/n,甲中n小,平均相对分子质量大,D错误,选A。
考点:考查考查影响化学平衡的因素,
本题难度:一般
4、选择题 在恒温下密闭容器内发生反应 P(g)+Q(g)?R(g)+S(g)已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
参考答案:A、该反应是一个反应前后气体体积不变的反应,无论反应是否达到平衡状态,容器内气体的压强始终不变,故错误.
B、反应达到平衡时,P、Q、R、S物质的量的浓度之比可能为1﹕1﹕1:1,也可能不是1﹕1﹕1:1,这与该反应的初始浓度及转化率有关,故B错误.
C、当反应到达平衡,P的生成速率和P的消耗速率相等,而P的消耗速率和S的生成速率相等,所以P的生成速率和S的生成速率相等,故C正确;
D、该反应是一个反应前后气体体积不变的反应,无论反应是否达到平衡状态,反应容器内的气体总物质的量始终不随时间变化,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 在密闭容器中,反应2X(g)+ Y2(g)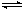 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是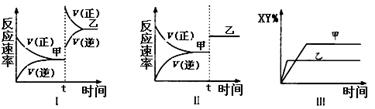
A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
参考答案:D
本题解析 :若升高温度,平衡向逆反应方向移动,图1不可能是升高温度,可能是增大压强,温度不变,平衡常数不变,故A错误;图Ⅱ表示加入催化剂正逆反应速率同程度的增大,平衡不移动,故转化率不变,B错误;增大压强,平衡向正反应方向移动,图Ⅱ反应速率增大,平衡不发生移动,故不肯能是增大压强,故C错误;乙先达到平衡,说明乙的反应速率快,故乙温度高于甲,D正确,答案选D.
考点:化学平衡图像
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《吸热反应与.. | |