微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)⑴请选择合适方法的字母代号填空:
①从海水中提取粗盐________; ② 煤转化为焦炭、煤焦油等________;
③ 工业上由氧化铝制取金属铝________; ④ 提纯氢氧化铁胶体________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原
G.电解 H.溶解 I.渗析 J.蒸发 K.氧化
⑵某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,此反应 (填是或不是)可逆反应;反应开始至2分钟时, _____ (能或不能)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态,此时正反应速率 逆反应速率(填等于或不等于)。
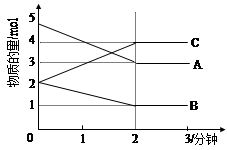
参考答案:(10分)⑴① J ② E ③ G ④ I
⑵ A和B , C , 是 ; 能 , 化学平衡 , 等于 (每空1分)
本题解析:(1)①从海水中提取粗盐,只需蒸发水分即可,选J;②煤转化为焦炭、煤焦油等需要将煤隔绝空气加强热进行干馏,选E;③工业电解氧化铝冶炼铝,选G;④提取交替用渗析的方法,选I;
(2)根据图像判断,物质的量减少的是反应物,增加的是生成物,所以A、B是反应物,C是生成物;一段时间后反应物、生成物的物质的量不再改变,所以该反应是可逆反应;反应开始至2分钟时,C的物质的量增加,可以用C表示反应速率;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态,此时正反应速率等于逆反应速率。
考点:考查物质的分离和提纯方法的判断,化学平衡、反应速率的判断
本题难度:一般
2、选择题 在密闭容器中达到平衡的化学反应N2O4(g)  2NO2(g) △H>0,改变条件,下列说法不正确的是?
2NO2(g) △H>0,改变条件,下列说法不正确的是?
[? ]
A.温度不变体积减小,反应速率增大,再次平衡时混合气颜色变浅
B.温度和体积不变,加入少许NO2,再次平衡时混合气中NO2的百分含量减少
C.体积不变时加入少许N2O4,再度平衡时颜色变深
D.体积不变时升高温度,再次平衡时混合气颜色变深
参考答案:A
本题解析:
本题难度:一般
3、填空题 (8分)在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。
A(g) 2B(g) + C(g) + D(s) △H =" +" 85.1 kJ / mol
2B(g) + C(g) + D(s) △H =" +" 85.1 kJ / mol
容器内气体总压强(P)与起始压强P。的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。

回答下列问题:
(1)下列能提高 A 的转化率的是 。
A.升高温度 B.向体系中通人A气体
C.减少D的物质的量 D.向体系中通人稀有气体He
(2)平衡时A的转化率为 (保留两位有效数字)。
(3)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围 n (D) mol 。
(4)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时 B 的浓度为
参考答案:(1)A;(2)70%;(3)>0.03;(4)0.0583mol/L。
本题解析:(1)A.该反应的正反应是吸热反应,升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动,对该反应来说向正反应方向移动,所以能提高 A 的转化率,正确;B.向体系中通人A气体 ,平衡正向移动,但是平衡移动消耗量远小于投入量,所以A的转化率反而降低,错误;C.由于D是固体,所以减少D的物质的量,平衡不发生移动,A的转化率不变,错误; D.向体系中通人稀有气体He,平衡不发生移动,所以A的转化率不变,错误;(2)在恒容的密闭容器内进行的反应,容器内气体的压强之比等于气体的物质的量的比。假设A转化物质的量为x,则平衡时各种气体的物质的量分别是:A:(0.1-x)mol;B:0.2xmol;C:xmol。根据表格提供的数据可知:[(0.1-x)+0.2x+0.1x]÷0.1=2.40,解得x=0.07mol,所以平衡时A的转化率为(0.07mol÷0.1mol)×100%=70%;(3)根据反应方程式可知:若相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 在平衡时含有A的物质的量为0.03mol,每产生1mol的A,就消耗1mol的D,所以D 的取值范围 n (D) >0.03mol。(4)在恒压条件下,气体的体积比等于气体的物质的量的比。将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时A 的转化率仍然为70%;则B的物质的量为0.1mol×0.7×2=0.14mol,平衡时各种气体的总物质的量为: 0.1mol×0.3+0.14mol+0.1mol×0.7=0.24mol;平衡时容器的容积是(0.24mol×1L)÷0.1mol=2.4L,所以B的物质的量浓度是c(B)= 0.14mol÷2.4L=0.0583mol/L。
考点:考查影响化学平衡移动的因素、物质的转化率、等效平衡、物质的平衡浓度的计算的知识。
本题难度:困难
4、填空题 在重铬酸钾(K2?Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:
Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)
(1)写出上述反应的平衡常数表达式:K=______
(2)向重铬酸钾中加入少量NaOH固体,溶液呈______色.
(3)向(2)所得的溶液中加入过量的稀硫酸,则溶液呈______色,因为______
(4)向原溶液中加入Ba(NO3)2溶液(Ba?CrO4为难溶性黄色沉淀),则平衡______(填“正向移动”、“逆向移动”或“不移动”),溶液颜色将______.
参考答案:(1)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)的平衡常数K=c2(CrO42-)?c2(H+)c(Cr2O72-),故答案为:c2(CrO42-)?c2(H+)c(Cr2O72-);
(2)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液呈黄色,故答案为:黄;
(3)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,
故答案为:橙红色;加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色;
(4)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,平衡正向移动,溶液的颜色变浅,
故答案为:正向移动;变浅.
本题解析:
本题难度:一般
5、填空题 (14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)
参考答案:
本题解析:
本题难度:困难