微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l)?△H=-103.7?kJ·mol-1
H2O(l)+H2NCONH2(l)?△H=-103.7?kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是__________。
A.采用高温?B.采用高压?C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)?(氨基甲酸铵)?△H1
H2NCOONH4(l)?(氨基甲酸铵)?△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)?△H2
H2O(l)+H2NCONH2(l)?△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5?L密闭容器中投入4?mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
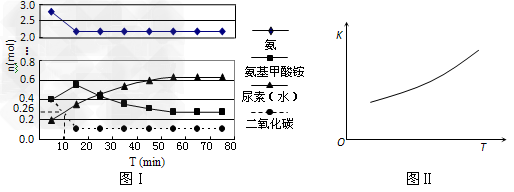
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_______步反应决定,总反应进行到?_______?min时到达平衡。
②反应进行到10?min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_________?。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2?________0(填“>”“<”或“=”)
④第一步反应的△S?________0(填“>”、“<”或,“=”),在________(填“较高”或“较低”)温度下有利于该反应自发进行。
参考答案:(1)B
(2)①?2;55;②0.148 mol/(L·min);③>;④<;较低
本题解析:
本题难度:一般
2、填空题 对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1)25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式______________;
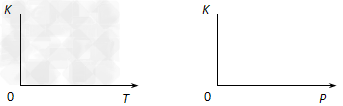
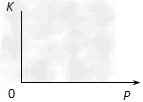
(2)25℃时,反应2CO2(g) 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是______________。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是______________。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
(3)1600℃时,反应2CO(g)+O2(g) 2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为_____________;
2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为_____________;
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式____________________。
参考答案:(1)C(石墨)+1/2O2(g)==CO(g) △H=-110.5kJ/mol
(2)[c2(CO)·c(O2)]/c2(CO2)<2.96×10-92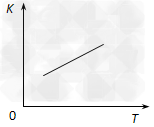 ;
; (3)94.5%±0.5%
(3)94.5%±0.5%
(4)CO-2e-+CO32-=2CO2
本题解析:
本题难度:一般
3、填空题 (14分)合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为 L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 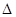 H=-41.16kJ/mol,对于该反应有关表述正确的是 。
H=-41.16kJ/mol,对于该反应有关表述正确的是 。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为 (保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为 ,碳酸氢钾溶液中离子浓度大小顺序为
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应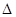 H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。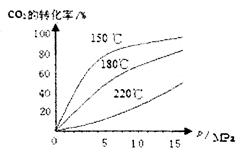
参考答案:(14分,每空2分)(1)17.92L
(2)b d 2.0
(3)10-4mol/L [K+]>[HCO3]>[OH]>[H+]
(4)< 净化后重新充入合成塔内,循环利用,提高原料利用率
本题解析:(1)甲烷在一定条件下与水反应的方程式为CH4+H2O→CO+3H2,即每生成4mol气体反应中就转移6ml电子。反应中每转移1.2mol电子,所得合成气在标准状况下的体积为 。
。
(2)缩小体系体积增大压强,则反应速率一定会增大,但反应前后气体的体积不变,故改变越强不影响平衡,a不正确。绝热条件下,若测得该体系温度不再改变,说明此时正逆反应速率相等,即达到平衡状态,b正确。正反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,c不正确。增加水蒸气用量虽然可降低自身的转化率,但会提高其它反应物的转化率,d正确。
(3)碳酸钾水解显碱性,促进了水的电离,所以下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为1×10-4mol/L。碳酸氢钾溶液显碱性是因为碳酸氢钾的水解程度大于其电离程度,所以溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
(4)由图像可看出,在等压时温度越高,二氧化碳的转化率越低,所以正反应是放热反应。为了提高原料的利用率,必须循环使用。
本题难度:困难
4、选择题 可逆反应:3A(g)?3B(?)+C(?)(△H>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
参考答案:3A(g)?3B(?)+C(?)(△H>0),该正反应吸热,温度升高,平衡右移,.M变小,依据反应的系数关系,气体平衡体系的质量守恒,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定;
A、B和C肯定不会都是固体,若都是固体,气体物质的量减小,质量减小,.M不变,故A错误;
B、若都是气体,反应前后气体物质的量一定增大,质量不变,.M减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,.M减小,故B错误;
C、C为固体,B一定为气体,反应前后气体物质的量不变,气体质量减小,.M减小,故C正确;
D、B和C可能都是气体时,质量守恒,气体物质的量增大,.M减小,故D正确;
故选CD;
本题解析:
本题难度:一般
5、选择题 在密闭容器中,使2molN2和6molH2混合发生反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应)下列说法错误的是( )
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是1:3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
参考答案:A、混合气体的平均相对分子质量=气体质量气体物质的量,反应前后质量守恒,升温平衡逆向进行,气体物质的量增大,混合气体的平均相对分子质量减小,故A错误;
B、混合气体密度=气体质量体积,升温平衡移动,但气体质量不变,体积不变,混合气体密度不变,故B正确;
C、起始量1:3,反应比为1;3,所以得到平衡浓度1;3,故C正确;
D、恒温恒容容器,加入氩气,总压增大,保持压强不变,体积增大,平衡逆向进行,故D正确;
故选A.
本题解析:
本题难度:简单