微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 将绿矾(FeSO4.7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
猜想
| 实验操作
| 预期现象
|
猜想一:Fe元素只显______价
| ①向所得溶液中滴入KSCN溶液
②向稀酸性KMnO4溶液中滴入所得溶液
| KSCN溶液无明显现象
|
猜想二;Fe元素只显______价
| 稀酸性KMnO4溶液颜色_____
|
猜想三:Fe元素既有+2价又有+3价
| KSCN溶液呈______色
稀酸性KMnO4溶液颜色______
|
?
实验二:为进一步探究该反应的产物,进行了如下图所示的实验
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是?
?。
②装置图中C的作用是?。
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为_____________
④该组同学设计的装置存在着一个明显的缺陷是??
参考答案:
猜想一:+2
猜想二: +3?褪为无色
猜想三:血红色?褪为无色
实验二:
①赶走装置内的空气
②防止产生倒吸
③2FeSO4.7H2O 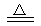 Fe2O3+SO2+SO3+14H2O
Fe2O3+SO2+SO3+14H2O
④未进行尾气处理
本题解析:略
本题难度:简单
2、选择题 关于物质的分离提纯,说法错误的是( )
A.蒸发操作可以从溶液中分离得到可溶性固体溶质
B.将待过滤的液体直接倒入漏斗中,且使液面低于滤纸边缘
C.蒸馏操作时,温度计的水银球不能伸入液面以下,只需靠近蒸馏烧瓶的支管口处
D.可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出
参考答案:A.蒸发分离可溶性固体与液体,则蒸发操作可以从溶液中分离得到可溶性固体溶质,故A正确;
B.过滤的液体应利用玻璃棒引流,且使液面低于滤纸边缘,故B错误;
C.蒸馏时,测定馏分的温度,则蒸馏操作时,温度计的水银球不能伸入液面以下,只需靠近蒸馏烧瓶的支管口处,故C正确;
D.植物油和水混合后分层,水在下层,则可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出,故D正确;
故选B.
本题解析:
本题难度:简单
3、实验题 某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。该反应的离子方程式为:2MnO4-+5H2C2O4+ 6H+=2Mn2+ + 10CO2↑+ 8H2O 该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01 mol·L-1、0.001 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.1 mol·L-1、0.2 mol·L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K。
(1)每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____________个实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)?

①用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率_________(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?_________(填“是”或“否”) 。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:_________________ 。
参考答案:(1)4
(2)① 1×10-4 mol·L-1·min-1
② 否; 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是
A.将SO2通入BaCl2溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失
B.用标准氢氧化钠溶液滴定一定量含甲基橙的盐酸,终点时溶液由橙色变成黄色
C.取少量加碘食盐加入淀粉溶液中,充分搅拌后溶液呈蓝色
D.配制FeSO4溶液时,加入少量稀硝酸以抑制其水解
参考答案:B
本题解析:略
本题难度:简单
5、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全不正确的是(? )
A.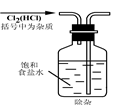 B?
B?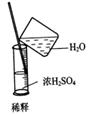 ?C
?C ? D.
? D.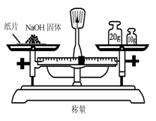
参考答案:ABD
本题解析:A、该操作会造成食盐水倒吸。
B、浓硫酸稀释的正确做法是将浓硫酸倒进水中。
D、用天平称量物品时,要注意是“左物右码”,因为NaOH有很强的吸湿性,很容易吸收空气中的水蒸气而潮解,直接暴露在空气中称量的话会造成误差除此外,还因为NaOH会和空气中的二氧化碳反应,生成NaCO3,降低样品的纯度,所以,可以用称量瓶来称量。
点评:此题考核了常见实验操作方法,要求学生平时的实验操作动作要规范,正确。
本题难度:简单