微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,都是共价化合物的是
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和HClO3
参考答案:D
本题解析:全部由共价键形成的化合物是共价化合物,所以D正确。过氧化钠,氟化钙是离子化合物,氮气是单质,均不符合。答案选D。
本题难度:简单
2、选择题 根据下列实验事实,能确定某晶体一定是离子晶体的是
A.晶体熔点达2500℃
B.晶体不导电,溶于水导电
C.晶体不导电,熔融能导电
D.温度越高,溶解度越大
参考答案:C
本题解析:
本题难度:简单
3、选择题 已知aX n+ 和bYm-两种离子的电子层结构相同,则下列关系成立的是
A.a = b+n-m
B.离子半径Y m-C.原子序数Y > X
D.离子半径X n+
参考答案:D
本题解析:两元素在周期表中的位置为:
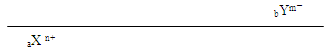
本题难度:一般
4、选择题 下列离子方程式正确的是
A.Fe3++Fe=2Fe2+
B.2Fe3++3Cu=2Fe+3Cu2+
C.Fe2++2H++H2O2=Fe3++2H2O
D.2Fe2++Cl2=2?Fe3++2Cl-
参考答案:D
本题解析:分析:A、离子方程式电荷不守恒;
B、氧化还原反应电子不守恒;
C、离子方程式中电荷不守恒、电子不守恒;
D、离子方程式符合原子守恒、电子守恒、电荷守恒;
解答:A、离子方程式电荷不守恒;离子方程式为:2Fe3++Fe=3Fe2+,故A错误;
B、氧化还原反应电子不守恒;离子方程式为:2Fe3++Cu=2Fe+Cu2+;故B错误;
C、离子方程式中电荷不守恒、电子不守恒;2Fe2++2H++H2O2=2Fe3++2H2O,故C错误;
D、离子方程式符合原子守恒、电子守恒、电荷守恒;2Fe2++Cl2=2Fe3++2Cl-,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的反应是解答的关键,并注意在离子反应中应遵循原子守恒,电子守恒,电荷守恒,题目难度不大.
本题难度:一般
5、选择题 下列实验能达到目的是
A.用溴水鉴别苯和正已烷
B.用BaCl2溶液鉴别SO42-与SO32-
C.用浓HNO3与Cu反应制备NO2
D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
参考答案:C
本题解析:分析:A.苯和正已烷都不溶于水,且密度比水小;
B.都生成沉淀;
C.浓HNO3与Cu反应生成NO2;
D.引入新的杂质.
解答:A.两者密度都比水小,均发生萃取,溴水层褪色,不能鉴别,故A错误;
B.两者都有沉淀生成,不能鉴别,故B错误;
C.浓硝酸具有强氧化性,可与Cu反应生成NO2,故C正确;
D.两者均能与NaHCO3溶液反应,而且引入CO2,故D错误.
故选C.
点评:本题考查元素化合物知识,题目难度不大,注意把握物质的性质的异同,鉴别物质时,应能产生不同的反应现象.
本题难度:简单