微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 用电除尘法可除去火力发电厂烟囱中大量的粉煤灰。已知粉煤灰的主要成分如下表,从粉煤灰中能够获得Al2O3。某校研究性学习小组设计了如图所示的提取Al2O3的工艺流程图。

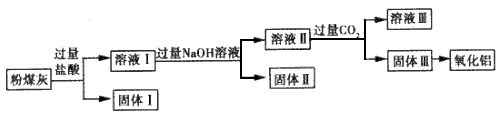
请回答下列问题。
(1)上述氧化物中能与NaOH溶液反应的是___。
(2)①固体I中含有的主要物质的化学式为__。
②向溶液Ⅱ中通人过量的CO2,发生反应的离子方程式为___。
(3)电解氧化铝制备金属铝时常常需加入冰晶石,冰晶石的作用是___,电解氧化铝的化学方程式为________,理论上从1t粉煤灰中可得到铝的质量为__。
参考答案:(1)SiO2.SO2和Al2O3
(2)①SiO2 ;
②OH-+CO2=HCO3-、? AlO2-+2H2O+CO2=Al(OH)3↓ +HCO3-
(3)使氧化铝在较低的温度下熔化;2Al2O3(熔融) 4Al+3O2↑? ;0.153 t
4Al+3O2↑? ;0.153 t
本题解析:
本题难度:一般
2、填空题 锌酸(H2ZnO2)盐不同于铝酸(H3AlO3)盐,锌酸盐稳定存在,如锌酸钠(Na2ZnO2)铝酸盐则不稳定,极易转化为偏铝酸盐,如铝酸对应的盐是偏铝酸钠(NaAlO2),而非铝酸钠(Na3AlO3)。
(1)ZnO类似于Al2O3,也是两性氧化物,试完成:
①Al2O3与NaOH(aq)的反应:____________________;
②ZnO与NaOH(aq)的反应:____________________。
(2)Zn(OH)2类似Al(OH)3,也是两性氢氧化物,试完成:
①Al(OH)3与NaOH(aq)的反应:____________________;
②Zn(OH)2与NaOH(aq)的反应:____________________。
(3)以上4个反应中,有没有氧化还原反应?若有,指出氧化剂和还原剂;若没有,说明理由。
(4)以上4个反应是不是离子反应?若是,请写出反应的离子方程式;若不是,请说明理由。
参考答案:(1)2NaOH+Al2O3══2NaAlO2+H2O
2NaOH+ZnO══Na2ZnO2+H2O
(2)NaOH+H3AlO3══2H2O+NaAlO2或NaOH+Al(OH)══NaAlO2+2H2O
2NaOH+H2ZnO2══Na2ZnO2+2H2O或2NaOH+Zn(OH)2══Na2ZnO2+2H2O
(3)没有;因为反应中各元素的化合价都没有发生变化(或因为4个反应都是复分解反应,复分解反应都不是氧化还原反应)。
(4)是;2OH-+Al2O3══2AlO2-+H2O,2OH-+ZnO══ZnO22-+H2O,Al(OH)3+OH-══AlO2-+2H2O,Zn(OH)2+2OH-══ZnO22-+2H2O。
本题解析:(1)Al2O3与NaOH(aq)发生反应:2NaOH+Al2O3══2NaAlO2+H2O
ZnO为两性氧化物,推知其对应盐为Na2ZnO2,则:2NaOH+ZnO══Na2ZnO2+H2O
(2)Zn(OH)2类似Al(OH)3,也是两性氢氧化物,则:
NaOH+H3AlO3══2H2O+NaAlO2或NaOH+Al(OH)3══NaAlO2+2H2O
2NaOH+H2ZnO2══Na2ZnO2+2H2O或2NaOH+Zn(OH)2══Na2ZnO2+2H2O
(3)上列4个反应,都是复分解反应,各元素的化合价反应前后都没有发生变化,因而都不是氧化还原反应。
(4)由于钠碱和钠盐易溶于水,且在水溶液里完全电离,所以4个反应都是离子反应。
本题难度:一般
3、填空题 物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:
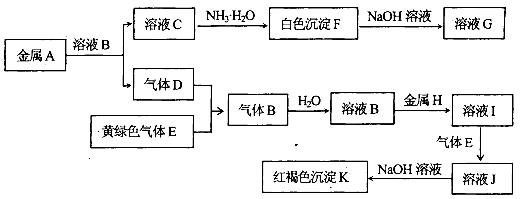
(1)写出下列物质的化学式:气体B是_____________,H是_______________,
(2)写出A与NaOH溶液反应的离子方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:_____________________________________________;
(4)写出反应“F→G”的离子方程式:____________________________________________;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
其反应的原理是(化学方程式)_________________________________________________.
(6)检验溶液J中的金属阳离子,用______________________试剂(填化学式),其现象是
_________________________________.
参考答案:
(1)HCl ,? Fe?
(2)2Al+2OH-+2H2O=2 AlO2-+3H2↑
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)Al(OH)3+OH-=AlO2-+2H2O
(5) 先出现白色沉淀,随即变成灰绿色,最后变成红褐色。
(6) KSCN, 溶液变为血红色,
本题解析:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,气体E是黄绿色气体判断为Cl2,D应为H2,E应为氧化性气体Cl2,B应为HCl,H为Fe,则I为FeCl2,J为FeCl3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)由以上分析可知B应为HCl? H为Fe?
(2)A与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2 AlO2-+3H2↑
(3)反应“I→J”是FeCl2和Cl2发生反应生成氯化亚铁,反应离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
(4)“F→G”的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:先出现白色沉淀,随即变成灰绿色,最后变成红褐色。4Fe(OH)2+O2+2H2O=4Fe(OH)3
(6)检验溶液J中的金属阳离子即Fe3+,可取溶液加入KSCN溶液,溶液变为血红色,证明有Fe3+。
本题难度:一般
4、选择题 在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是(?)
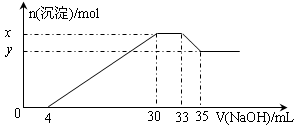
A.原溶液中n(Mg2+)∶n(Al3+)=10∶1
B.原溶液的c(H+)=0.8 mol/L
C.x与y的差值为0.01 mol
D.原溶液中c(Cl-)=0.66mol/L
参考答案:D
本题解析:由图象可知,开始加入氢氧化钠没有沉淀生成,0~4mL发生反应H++OH-=H2O,4mL时H +反应完毕,4~30mL发生反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,30mL时沉淀量最大,Mg2+、Al3+沉淀完全,30~33mL沉淀量不变,发生NH4+与氢氧化钠的反应NH4++OH-=NH3·H2O,33~35mL发生Al(OH)3与氢氧化钠的反应Al(OH)3+OH-=AlO2-+2H2O,0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×4mol?L-1=0.016mol,c(H+)=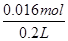 =0.08mol/L,故B错误;由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×4mol?L-1=0.008mol,即Al(OH)3的物质的量=0.008mol,故C错误;溶液中的阴离子只有Cl―,则加入33mLNaOH溶液时Cl―全部存在于NaCl中,则Cl―的物质的量为33mL×10-3L×4mol?L-1=0.132mol,原溶液中c(Cl―)=
=0.08mol/L,故B错误;由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×4mol?L-1=0.008mol,即Al(OH)3的物质的量=0.008mol,故C错误;溶液中的阴离子只有Cl―,则加入33mLNaOH溶液时Cl―全部存在于NaCl中,则Cl―的物质的量为33mL×10-3L×4mol?L-1=0.132mol,原溶液中c(Cl―)=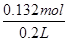 =0.66mol/L,故D正确;由C计算可知n[Al(OH)3]=0.008molmol,则原溶液中n(Al3+)=n[Al(OH)3]=0.008mol,由图可知溶解Al(OH)3消耗氢氧化钠溶液5mL,则沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,则n(NaOH)=(30-4)mL×10-3L×4mol?L-1=0.104mol,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),则n[Mg(OH)2]=
=0.66mol/L,故D正确;由C计算可知n[Al(OH)3]=0.008molmol,则原溶液中n(Al3+)=n[Al(OH)3]=0.008mol,由图可知溶解Al(OH)3消耗氢氧化钠溶液5mL,则沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,则n(NaOH)=(30-4)mL×10-3L×4mol?L-1=0.104mol,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),则n[Mg(OH)2]=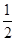 (0.104mol-0.008mol×3)=0.04mol,故原溶液中n(Mg2+)=0.04mol,故原溶液中n(Mg2+):n(Al3+)=5:1,故A错误;
(0.104mol-0.008mol×3)=0.04mol,故原溶液中n(Mg2+)=0.04mol,故原溶液中n(Mg2+):n(Al3+)=5:1,故A错误;
本题难度:一般
5、推断题 (本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:
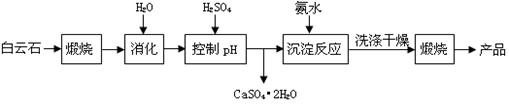
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石?。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要?(填序号)。
A.蒸发皿? B.坩埚? C.泥三角? D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:

①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质? B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
温度(℃)
| 40
| 50
| 60
| 70
|
MgSO4
| 30.9
| 33.4
| 35.6
| 36.9
|
CaSO4
| 0.210
| 0.207
| 0.201
| 0.193
|
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是?、?。
(4)写出沉淀反应中的离子方程式:?。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,
向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的
颜色为?(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
pH
| < 8.0
| 8.0 ~ 9.6
| > 9.6
|
颜色
| 黄色
| 绿色
| 蓝色
|
?
参考答案:32. 答案(16分)
(1)粉碎 (2分)BC (2分)
(2)①镁浸出率降低(1分)Mg(OH)2或MgO未完全溶解(1分)
②产品纯度下降(1分)AC (1分)
(3)升温结晶、趁热过滤 (2分,各1分))
(4)Mg2+ +2NH3.H2O = Mg(OH)2↓+ 2NH4+(2分)
(5)(NH4)2SO4(2分)
(6)蓝色 (2分)
本题解析: (1)提高矿石煅烧效果的措施通常是对矿石进行粉碎处理,以增大反应的接触面积,从而加快反应速率,使煅烧更加充分。若在实验室煅烧白云石,煅烧需要的配套装置有酒精灯、三脚架、坩埚、泥三角坩、埚钳等,所以此处必须选BC。
(2)①图像中有两条曲线,根据提示曲线上打黑点的是镁浸出率曲线,该曲线随着横坐标终点pH的增大,呈现出逐渐下降的趋势,且当pH>6时,浸出率下降得越来越快;而曲线上打小方点的是氧化镁的纯度,该纯度随着横坐标终点pH的增大呈现出增大的趋势,但是较不同的是,开始增大迅速,当pH>6时,氧化镁的纯度增大不明显。所以①pH过高会导致镁的浸出率降低,原因是加硫酸溶解时,若pH过高,则沉淀物MgO不能完全溶解。
②pH过低会引起制得的氧化镁的纯度偏低,原因是白云石中的氧化物杂质Fe2O3、CaO都会溶于硫酸,并且生成可溶的物质,所以AC均有可能,选AC。
(3)由表中数据可知,硫酸镁易溶于水,溶解度随温度升高而升高,而硫酸钙则微溶于水,随着温度升高溶解度基本不变,所以利用二者溶解度上的差异,若要析出硫酸钙晶体来,可以采取的措施是升温结晶、趁热过滤。
(4)沉淀步骤中反应池中的主要为镁离子,所以加入氨水,氨水和镁离子结合生成沉淀氢氧化镁,所以离子方程式是Mg2+ +2NH3.H2O = Mg(OH)2↓+ 2NH4+ ,注意氨水不能拆。
(5)当沉淀步骤析出Mg(OH)2 后,溶液还剩下NH4+ 和SO4 2-,所以可以利用此剩余溶液制得副产品(NH4)2SO4 ,可用于做氮肥。
(6)饱和的氢氧化镁溶液存在Mg(OH)2 (s)= Mg2+(aq) + 2 OH-(aq)溶解平衡,2c(Mg2+)= c(OH -),又溶度积Ksp= c(Mg2+)c2(OH -)=5.6×10-12 ,由此可以得出c(OH -)=3.6×10-4 ,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色。
本题难度:一般