| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《离子共存》答题技巧(2017年最新版)(二)
参考答案:C 本题解析:A项中HCO3- 不能在酸性溶液中共存。B项中Cu2+为蓝色。D项中Fe3+在该溶液中为黄棕色,故不符合题意。正确选C。 本题难度:简单 3、选择题 在pH =0的溶液中,能大量共存的离子组是 ( ) |
参考答案:C
本题解析:由pH =0知溶液呈酸性,A中NO-3在酸性条件下会氧化Fe2+而不能大量共存,A去掉;H+与CH3COO-、HCO-3均反应生成弱电解质而不能大量共存,B去掉;Ba2+和SO2-4反应生成难溶物而不能大量共存,D去掉。答案选C。
本题难度:一般
4、选择题 下列各组中的离子,能在溶液中大量共存是( )
A.H+、K+、OH-、SO42-
B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、CO32-、Cl-
D.Na+、Cu2+、SO42-、Cl-
参考答案:A、H+、OH-两种离子能结合成水而不能大量共存,故A错误.
B、Ca2+、CO32-两种离子能结合成CaCO3沉淀而不能大量共存,故B错误.
C、H+与CO32-反应生成水和二氧化碳,不能大量共存,故C错误.
D、Na+、Cu2+、SO42-、Cl-四种离子间不能结合成沉淀、气体或水,能大量共存,故D正确.
故选:D.
本题解析:
本题难度:一般
5、选择题 某未知溶液可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和K+。取100mL该溶液进行实验,过程记录如下。由此可知原溶液中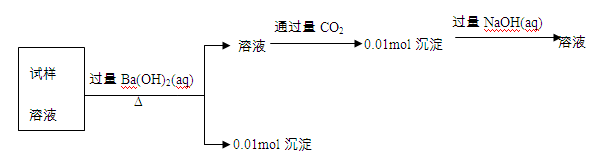
A.一定有Cl-
B.一定有CO32-
C.一定没有K+
D.一定没有Mg2+
参考答案:A
本题解析:溶液中通入CO2生成的0.01mol沉淀能溶解在氢氧化钠溶液中,这说明沉淀是氢氧化铝,因此溶液是偏铝酸钠,则一定含有0.01mol铝离子,因此一定不能存在碳酸根离子。试样溶液加入过量的氢氧化钡生成0.01mol沉淀,则沉淀可能是硫酸钡或氢氧化镁或是二者的混合物。即硫酸根离子的最大值是0.01mol,而铝离子是0.01mol,所以根据电荷守恒可知一定还含有氯离子,答案选A。
考点:考查离子共存与检验的有关判断
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《维生素与人.. | |