微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于元素性质的有关叙述中不正确的是
A. C、N、O、F的原子半径依次减小
B. Na、K、Rb、Cs的失电子能力逐渐增强
C. C、N、O、F的最高正价依次升高
D. Na、Mg、Al、Si的最外层电子数依次增加
参考答案:C
本题解析:A正确,同周期从左到右原子半径减小;B正确,同主族元素从上到下原子半径增大,失电子能力增强;C错,O、F无正价;D正确,同周期从左到右最外层电子数增加;
本题难度:简单
2、选择题 钋单质为银白色金属,在黑暗中能发光,它有两种不同结构的单质α-Po和β-Po,钋元素的质量数是从192到218的全部核素。下列有关钋元素的说法中错误的是
A.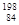 Po和
Po和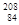 Po互为同位素
Po互为同位素
B.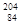 Po和
Po和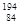 Po中子数差为20
Po中子数差为20
C.α-Po和β-Po互为同素异形体
D.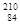 Po和
Po和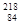 Po的核外电子总数相同,但不是同一种核素
Po的核外电子总数相同,但不是同一种核素
参考答案:B
本题解析:
A.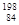 ?Po和
?Po和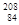 Po质子数都为84,质量数不同说明中子数不同,互为同位素
Po质子数都为84,质量数不同说明中子数不同,互为同位素
B.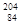 Po中子数为204-84=120,
Po中子数为204-84=120,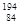 Po中子数为194-84=110,差为10,错误。
Po中子数为194-84=110,差为10,错误。
C.α-Po和β-Po是钋的两种不同结构的单质,互为同素异形体。
D.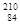 Po和
Po和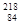 Po的核外电子总数相同,都是84,但是中子数不同,属于质子数相同中子数不同的核素,不是同一种核素,是同种元素的不同核素
Po的核外电子总数相同,都是84,但是中子数不同,属于质子数相同中子数不同的核素,不是同一种核素,是同种元素的不同核素
本题难度:一般
3、选择题 下列说法中错误的是
A.键长愈长,化学键愈不牢固
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.原子及其离子的核外电子层数均等于该元素所在的周期数
参考答案:D
本题解析:略
本题难度:一般
4、选择题 适宜用分液漏斗进行分离的一组混合物是
A.乙酸和乙醇
B.水和氯化钠
C.水和花生油
D.四氯化碳和碘
参考答案:C
本题解析:只有互不相容的液体之间才能通过分液漏斗进行分离,花生油不溶于水,其余都是易溶或互溶的,所以答案选C。
本题难度:困难
5、选择题 化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=(NH?3通过如下反应制得:3CH4+2?HB=NH)3+6H2O=3CO2+6H3BNH3。对合成A反应方程式的讨论中不正确的是( )
A.反应前后碳原子的杂化类型不变
B.键角的大小关系:CO2>CH4>H2O
C.第一电离能大小关系:N>O>C>B>H
D.生成物H3BNH3中存在配位键
参考答案:A
本题解析:由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp。
本题难度:一般