| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《有关氧化还原反应的计算》高频考点特训(2017年练习版)(八)
参考答案:A 本题解析:根据NO2和NO的体积相等时,其方程式中的系数相等,根据得失电子守恒,可推出该反应的方程式为2Cu2S+14HNO3 = 2Cu(NO3)2+2CuSO4+5NO2↑+5NO↑+7H2O,所以实际参加反应的Cu2S与HNO3的物质的量之比为1∶7,故选A。 本题难度:一般 2、填空题 (13分)近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为: |
参考答案:(13分)(1)3C+2K2Cr2O7+8H2SO4===3CO2+2K2SO4+2Cr2(SO4)3+8H2O(3分)
(2)K2Cr2O7 CO2(各2分) (3)A (3分) (4)1.204×1024(3分)
本题解析:根据化合价升降法可配平氧化还原反应方程式,反应中C的化合价升高氧化产物为CO2,K2Cr2O7 中Cr元素化合价降低,K2Cr2O7为氧化剂;H2SO4在反应中化合价没变,只表现出了酸性;根据配平后的方程式,生成3mol气体时转移12mol电子,当生成标况下11.2 L气体时,转移电子11.2L/22.4L/mol/3×12mol=2mol,即1.204×1024个电子。
考点:氧化还原反应方程式的配平及计算
本题难度:一般
3、选择题 6.4gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)?若干,这些混合气体恰好能被500mL?1mol/L?NaOH溶液完全吸收,生成的盐溶液中NaNO3和NaNO2的物质的量之比为( )
(已知:NO+NO2+2NaOH→2NaNO2+H2O?2NO2+2NaOH→NaNO3+NaNO2+H2O?)
A.2:1
B.1:1
C.4:1
D.1:3
参考答案:纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO3)2,每个Cu升2价,失2个电子;另一个是HNO3到NaNO2,每个N降2价,得2个电子.根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,故2n(Cu)=2n(NaNO2),故n(NaNO2)=n(Cu)=6.4g64g/mol=0.1mol,
气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),
所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×1mol/L-0.1mol=0.4mol,
溶液液中NaNO3和NaNO2的物质的量之比为0.4mol:0.1mol=4:1,
故选C.
本题解析:
本题难度:一般
4、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.氢化铵的电子式: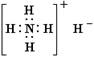
B.甲醇分子的球棍模型: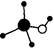
C.次氯酸分子的结构式: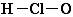
D.Ge原子结构示意图:
参考答案:B
本题解析:A、氢化铵中氢离子应含有两电子,选项中未表示出,故错误。B选项正确。C、次氯酸分子的结构式应为:H-O-Cl 故错误。D、Ge原子应为第32号元素,故选项中错误。
本题难度:一般
5、选择题 下列化学用语正确的是(?)
A.锂离子的结构示意图: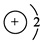
B.碳原子的轨道表示式: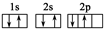
C.丁烷的最简式:C2H5
D.氯化镁的电子式:Mg2+[∶····∶]2-
参考答案:C
本题解析:A项锂离子的结构示意图内部核电荷数是+3;B项碳原子的电子排布图中2p中2个电子的自旋状态相同; C项丁烷的最简式正确;D项应该是[∶····∶]-Mg2+[∶····∶]-。
点评:常见的化学用语要会准确使用。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《与量有关的.. | |