微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操?作
| 现?象
|
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH
| pH试纸变红(约为4)
|
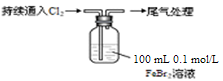
| ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄;
ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色;
iii.稍后,溶液由棕黄色变浅,最终变为黄色
|
?
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是?。
(2)pH≈4的原因是?(用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是?;证明原因②的实验方案是?。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 ?。
试管
| 操作
| 现象
| 结论
|
a
| 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡
| ?
?
| Cl2的氧化性强于Fe3+
|
b
| 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡
| CCl4层没有明显变化
| ?
?
|
c
| ?
| CCl4层由无色变为橙黄色
| Cl2的氧化性强于Br2
|
?
参考答案:(1)MnO2+4HCl MnCl2+Cl2↑+2H2O;?(1分)
MnCl2+Cl2↑+2H2O;?(1分)
(2)Fe2++2H2O Fe(OH)2+2H+?(1分 )
Fe(OH)2+2H+?(1分 )
(3)取少量i中溶液放入试管中,滴加KSCN溶液,若溶液变红,说明①对,否则不成立;(2分)
取5 mL上述黄色溶液于试管中,向其中滴加少量CCl4 ,振荡,若CCl4层呈现橙红色,说明原因②对;否则不成立。?(2分)
(4)a.溶液变成红色(1分)
b.氧化性Fe3+ <Br2或 还原性Fe2+ >Br-?(1分)
c.取2 mL 溴化钠溶液,滴加少量氯水和少量CCl4,振荡(1分)
结论:猜测①是正确的。(1分)
本题解析:(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是MnO2+4HCl MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)pH≈4的原因是亚铁离子水解使溶液显酸性,离子方程式是Fe2++2H2O Fe(OH)2+2H+
Fe(OH)2+2H+
(3)溶液变成黄色,若①对,溶液中存在Fe3+,取少量i中溶液放入试管中,滴加KSCN溶液,若溶液变红,说明①对,否则不成立;
若②对,溶液中存在溴单质,取5 mL上述黄色溶液于试管中,向其中滴加少量CCl4 ,振荡,若CCl4层呈现橙红色,说明原因②对;否则不成立。
(4)a.Cl2的氧化性强于Fe3+,所以氯气将亚铁离子氧化成Fe3+,滴加KSCN溶液,溶液变红;
b.CCl4层没有明显变化,说明Fe3+不能将Br-氧化生成Br2,结论是氧化性Fe3+ <Br2或 还原性Fe2+ >Br-
c.验证氯气的氧化性强于单质溴氧化性,需进行的操作是取2 mL 溴化钠溶液,滴加少量氯水和少量CCl4,振荡 ; 结论:猜测①是正确的
本题难度:一般
2、选择题 已知I-、Fe2+、SO2、Cl-?和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( )
A.H2O2+H2SO4══SO2↑+O2↑+2H2O
B.I2+SO2+2H2O══H2SO4+2HI
C.2Fe2++Cl2══2Fe3++2Cl-
D.2Fe3++SO2+2H2O══2Fe2++SO42-+4H+
参考答案:A、标注元素化合价可知,反应中硫元素化合价降低,过氧化氢中氧元素化合价升高,所以根据规律判断还原性强弱,还原剂H2O2的还原性大于还原产物SO2,和题意不符,故A错误;
B、反应中还原剂SO2的还原性大于还原产物HI,符合题给条件,反应能进行,故B正确;
C、反应中还原剂Fe2+的还原性大于还原产物Cl-,符合题给条件,故C正确;
D、反应中还原剂SO2的还原性大于还原产物Fe2+,符合题给条件,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 下列有关描述中不正确的是( )
A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
B.反应A(g)+3B(g)?2C(g)达平衡后,温度不变,增大压强,平衡正向移动但平衡常数K不变
C.在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)<KSP(AgCl)
D.常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0
参考答案:A、氧化还原反应中 氧化剂的氧化性大于氧化产物;氧化剂的氧化性一定强于氧化产物的氧化性,故A正确;
B、平衡常数是随温度变化,不随浓度压强改变;反应A(g)+3B(g)?2C(g)达平衡后,温度不变,恒容容器中加入惰性气体,总压增大,分压不变,平衡不动,故B错误;
C、阴阳离子比相同的物质可以用Ksp大小比较溶解性,溶解性碘化银小于氯化银;说明同温度下KSP(AgI)<KSP(AgCl),故C正确;
D、常温下硝酸铵溶于水是一个能自发进行的吸热过程,硝酸铵溶解成为自由移动的离子,是熵变增大的过程,说明该过程的△S>0,故D正确;
故选C.
本题解析:
本题难度:简单
4、选择题 根据下列反应判断下列各物质的氧化性由强至弱的顺序正确的是( )
(1)Ca(ClO)2+4HCl=CaCl2+2Cl2+2H2O (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2KI=2FeCl2+2KCl+I2
A.Ca(ClO)2>FeCl3>Cl2>I2
B.Cl2> Ca(ClO)2> FeCl3>I2
C.Ca(ClO)2>Cl2>FeCl3>I2
D.Ca(ClO)2>Cl2>I2>FeCl3