微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A元素的最高正化合价和最低负化合价的绝对值之差为6,B元素与A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是
[? ]
A.MgCl2?
B.CaF2?
C.SiO2?
D.CS2
参考答案:A
本题解析:
本题难度:简单
2、简答题 下表是元素周期表的一部分,请回答有关问题:
主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
|
(1)最活泼的非金属元素是______(用元素符号或化学式表示,下同);碱性最强的是______,该物质存在的化学键类型是______
(2)⑤元素与⑧元素形成化合物的电子式是______
(3)③⑦⑧三种元素原子半径由小到大的顺序是______
(4)将⑤⑥两种单质用导线相连后,同时浸入稀硫酸中,⑥这一极发生______(填“氧化”或“还原”)反应.
参考答案:根据元素在周期表中的分布知识,可以推知①为C,②为N,③为F,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ar.
(1)同周期元素的原子,从左到右非金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱,同主族元素的原子,从下到上非金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱所以非金属性最强的元素在右上角,即为F,碱性最强的在左下角,为NaOH,氢氧化钠是含有离子键和共价键的共价化合物,故答案为:F;NaOH;离子键、共价键;
(2)氯化镁是氯离子和镁离子之间通过离子键形成的离子化合物,电子式为:
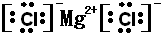
,
故答案为:
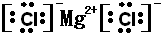
;?
(3)电子层越多半径越大,所以F的半径最小,电子层一样多时,核电荷数越多半径越小,所以Cl<S,故答案为:F<Cl<S;
(4)⑤为Mg,⑥为Al,镁、铝、硫酸构成的原电池,金属铝做正极,发生还原反应,故答案为:还原.
本题解析:
本题难度:一般
3、选择题 短周期元素X和Y可组成化合物XY3,当X的原子序数为m时,Y的原子序数可能是
①m+4 ②m-4 ③m-8 ④m+2 ⑤m-6 ⑥m+12
A.①②③
B.①④⑤⑥
C.①②③④⑤
D.①②③④⑤⑥
参考答案:D
本题解析:若X为金属,显+3价,则可在ⅢA族,Y显-1价,在ⅦA族.此时,若X、Y同周期,则Y的原子序数为m+4;若Y在X的上一周期,则其原子序数为m+4-8=m-4;若Y在X的下一周期,则其原子序数为m+4+8=m+12;若X为非金属,则还可能为SO3、PCl3、NH3等,Y的原子序数依次可表示为m-8、m+2、m-6.
本题 难度:困难
4、选择题 下列排列顺序正确的是( )
A.热稳定性:H2O>HF>H2S
B.最高正化合价:F>N>C
C.非金属性:Cl>S>Si
D.酸性:H2CO3>H3PO4>H2SO4
参考答案:A.非金属性F>O>S,元素的非金属越强,对应的氢化物越稳定,故A错误;
B.F没有正价,最高价为0价,故B错误;
C.同周期元素从左到右,非金属性逐渐增强,则有Cl>S>Si,故C正确;
D.非金属性S>P>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故D错误.
故选C.
本题解析:
本题难度:一般
5、推断题 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。
请回答下列问题:
(1)X元素原子基态时的电子排布式为____________,该元素的符号是________________;
(2)Y元素原子的价层电子的轨道表示式为_______________,该元素的名称是_____________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由________________________________。
参考答案:(1)1s22s22p63s23p63d104s24p3;As
(2)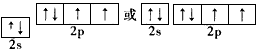 ;氧
;氧
(3)三角锥形
(4)As2O3+6Zn+6H2SO4==2AsH3↑+6ZnSO4+3H2O
(5)稳定性:NH3> PH3> AsH3,因为键长越短,键能越大,化合物越稳定沸点:NH3> AsH3> PH3,
NH3可以形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高
本题解析:
本题难度:困难