微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
|
(1)在这些元素中,化学性质 的是:______
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是______,碱性最强的化合物的是:______.
(3)最高价氧化物是两性氧化物的元素是______;写出它的氢氧化物与氢氧化钠反应的离子方程式______.
(4)用电子式表示元素④与⑥的化合物的形成过程:______,该化合物属于______(填“共价”或“离子”)化合物.
(5)表示①与③的化合物的电子式______,该化合物是由______(填“极性”“非极性”下同)键形成的.
参考答案:根据元素在周期表中的分布,可以推知①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)在这些元素中,化学性质最稳定的是稀有气体Ar,故答案为:Ar;
(2)根据元素周期律:同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱可以推知酸性最强的式是高氯酸,碱性最强的是KOH,故答案为:HClO4;KOH;
(3)氢氧化铝是两性氢氧化物,所以最高价氧化物是两性氧化物的元素是Al,能和强碱反应生成盐和水,实质是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al;Al(OH)3+OH-=AlO2-+2H2O;
(4)硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为:
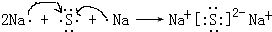
,故答案为:
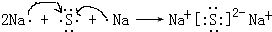
;离子;
(5)二氧化碳是碳原子和氧原子间通过极性共价键形成的共价化合物,电子式为:
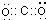
,故答案为:
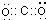
;极性.
本题解析:
本题难度:一般
2、选择题 下列分子中,所有原子都满足最外层为8电子结构的是
A.CH4
B.NO
C.CCl4
D.SO2
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列实验不能作为判断依据的是( )
A.钠和镁分别与冷水反应,判断钠和镁金属性强弱
B.通过铁、锌和稀硫酸形成原电池,判断铁与锌的金属性强弱
C.碳酸钠溶液中通入SO2产生气泡,判断碳与硫的非金属性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱
参考答案:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,故A正确;
B、铁、锌和稀硫酸形成原电池,活泼金属做负极,锌的金属性强于铁,故B正确;
C、碳酸钠溶液中通入SO2产生气泡,只能证明亚硫酸的酸性强于碳酸,故C错误;
D、卤素单质与氢气化合越容易,非金属性越强,故D正确;
故选C.
本题解析:
本题难度:简单
4、填空题 根据元素在周期表中的位置,回答下列有关问题:
(1)在1~18号元素中,非金属性最强的元素是______,金属性最强的元素是______.
(2)位于第三周期第VA族的元素的名称为______.
(3)C原子和O原子半径较大的是______.
参考答案:(1)在元素周期表中,非金属性最强的元素在周期表右上角、金属性最强的元素在周期表左下角,稀有气体除外,所以非金属性最强的元素是F、金属性最强的元素是Cs,故答案为:F;Cs;
(2)位于第三周期第VA族的元素的每个电子层上电子数分别为2、8、5,其核外电子数是15,元素原子序数与其原子核外电子数相等,该元素的原子序数是15,为磷元素,故答案为:磷;
(3)同一周期元素中,原子半径随着原子序数的增大而减小,C、O位于同一周期,且C的原子序数小于O,所以原子半径C的较大,故答案为:C.
本题解析:
本题难度:简单
5、填空题 下列原子序数所对应的元素组中,两者可形成离子键的是
[? ]
A.1和17
B.12和9
C.14和6
D.15和8
参考答案:B
本题解析:
本题难度:简单