| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《化学平衡》考点强化练习(2017年押题版)(十)
参考答案:C 本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,就是条件下的最大限度,因此④可以说明。根据方程式可知,反应前后气体体积不变,所以压强始终是不变的。密度是混合气的质量和容器容积的比值,容积不变,但混合气的质量是变化的,②可以说明。混合气体的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,总的物质的量不变,质量变化,所以③也可以说明。答案选C。 本题难度:一般 2、填空题 在一定条件下,反应A(气)+B(气) |
参考答案:(1) (B);(2) (C);(3) (E);(4) (A);(5) (D)
本题解析:根据反应的方程式可知,该反应是体积减小的、放热的可逆反应。据此可知:
(1)升高温度则正逆反应速率都增大,但平衡向逆反应方向移动,答案选B。
(2)降低压强,正逆反应速率都是降低的,但平衡向逆反应方向移动,答案选C。
(3)减少C的物质的量,则逆反应速率降低,正反应速率不变,平衡向正反应方向移动,答案选E。
(4)增加A的质量,反应物浓度增大,正反应速率增大,逆反应速率不变,平衡向正反应方向移动,答案选A。
(5)催化剂不能影响平衡状态,但可以改变反应速率,所以答案选D。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确外界条件是如何影响反应速率和平衡状态的,并能结合题意灵活运用即可。
本题难度:一般
3、选择题 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A.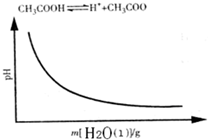
B.
C.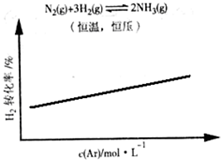
D.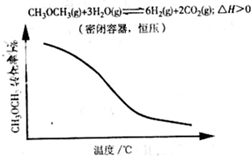
参考答案:A、CH3COOH溶液中存在电离平衡,随着加水稀释,电离平衡正向移动,c(H+)减小,pH逐渐增大,与图中不符合,故A错误;
B、因该反应中K+、Cl-实际不参加反应,则加入KCl对平衡体系无影响,化学平衡不移动,铁离子的浓度不变,与图中符合,故B正确;
C、恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度减小(等效于减压),化学平衡朝体积增大方向移动,反应逆向进行,H2的改变量减小,起始量不变,转化率减小,图中不符合,故C错误;
D、因反应为吸热反应,则体积、压强不变时,升高温度,平衡正向移动,则甲醚的转化率增大,与图中不相符合,故D错误;
故选B.
本题解析:
本题难度:一般
4、填空题 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+ O2(g)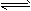 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题: 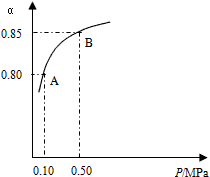
①将2.0molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_______________。
②平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用
NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4, M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示: 
请写出MFe2Ox分解SO2的化学方程式____________________(不必配平)。
参考答案:(1)①800L/mol;②=
(2)1.60NA;173.4
(3)MFe2Ox+SO2→MFe2O4+S
本题解析:
本题难度:一般
5、填空题 反应C(s)+H2O(g)?CO(g)+H2(g)在可变容积的密闭容器中进行,达到平衡后发生下列改变,对化学反应速率和化学平衡有何影响?
①容器的体积缩小一半,反应速率______?(填“增大”、“减小”或“不变”,下同);平衡______移动(填“向右”、“向左”或“不移动”,下同).
②保持体积不变,充入N2,使体系的压强增大一倍,反应速率______;平衡______移动
③保持压强不变充入N2,反应速率______;平衡______移动.
参考答案:①容器的体积缩小一半导致气体的压强增大1倍,增大压强,反应速率增大,平衡向气体体积减小的方向移动,即向左移动;
故答案为:向左;
②保持体积不变,充入N2,使体系的压强增大一倍,但H2O(g)、CO、H2的浓度不变,所以反应速率不变,平衡不移动;
故答案为:不变,不移动;
③保持压强不变充入N2,H2O(g)、CO、H2三种气体的分压减小,减小压强,平衡向气体体积增大的方向移动,即向右移动;
故答案为:减小,向右.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质结构和.. | |