微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。?
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
参考答案:(14分)(1)强氧化性(1分)? Cl2+2OH-=ClO-+Cl-+H2O(2分)
(2)2? 2? H2O? 2? 2? 1(水分子1分,系数1分,共2分)
(3)①2ClO-+SO2=2ClO2+SO42-(2分)?②1.6mol(2分)?③2:5(2分)
(4)32(2分)?强(1分)
本题解析:(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性。氯气能被氢氧化钠溶液吸收,所以工业上用氯气和NaOH溶液生产消毒剂NaClO,有关反应的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O。
(2)根据物质的化学式可知,反应前后元素化合价发生变化的是氯元素。其中部分氯元素的化合价从0价升高到+1价,部分降低到-1价,所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是2:1.根据原子守恒可知,反应前还有水参加,所以配平后的方程式是2 Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O.
(3)①KClO3与SO2在强酸性溶液中反应可制得ClO2,在反应中SO2被氧化生成硫酸钾,所以此反应的离子方程式为2ClO-+SO2=2ClO2+SO42-。
②ClO2遇浓盐酸会生成Cl2,则该反应的化学方程式是2ClO2+8HCl(浓)=4H2O+5Cl2↑。根据方程式可知反应中转移电子的个数是8个,所以每生成1mol Cl2转移电子的物质的量为8mol÷5=1.6mol。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-。在反应中氯元素的化合价从+4价降低到-1价,得到5个电子。Mn元素的化合价从+2价升高到+4价,失去2个电子,所以根据电子的得失守恒可知,该反应过程中氧化剂与还原剂的物质的量之比为2:5。
(4)设断开1 mol H-O键与断开1 mol H-Cl键所需能量分别是x与y,由于反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据题意可知4y+498kJ-2×243 kJ-4x=-115.6 kJ,解得x-y=32 kJ,因此H2O中H—O键比HC1中H—Cl键强。
本题难度:一般
2、选择题 Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确的是(? )
A.该反应中氧化剂是Cl2
B.根据该反应可判断还原性:S2O32- > Cl-
C.上述反应中,每生成l mol SO42-,可脱去2mol Cl2
D.SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂
参考答案:D
本题解析:D.二氧化硫和有色物质化合生成不稳定的无色物质;氯气具有强氧化性,可以将有色物质氧化,氧化成无色物质。
本题难度:简单
3、选择题 用玻棒蘸取新制氯水滴在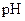 试纸中部,观察到的现象是
试纸中部,观察到的现象是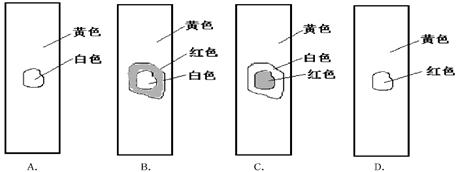
参考答案:B
本题解析:略
本题难度:一般
4、选择题 现有三种常见的治疗胃病的药品标签:
①INDICALM消化药片每片含250 mg碳酸钙 ②Stomachease减缓胃痛每片含250 mg氢氧化镁 ③Fast digestion帮助消化每片含250 mg氧化镁药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
A.①=②=③
B.①>②>③
C.③>②>①
D.②>③>①
参考答案:C
本题解析:假如要中和胃酸中HCl质量为36.5g,那么所需胃药质量越大,该种药品中和胃酸的能力解越弱.
各反应物之间的定量反应关系为
CaCO3~2HCl? Mg(OH)2~2HCl? Mg0~2HCl,找出各物质质量比,
100? 73? 58? 73? 40? 73?
通过分析看以看出:反应73克盐酸,分别消耗三种药品的质量依此为100克、58克、40克
所以三种药品中和胃酸的能力氧化镁最强、其次氢氧化镁、最弱的是碳酸钙.
故选C
点评:本题主要考查学生运用化学方程式进行计算的能力.
本题难度:简单
5、选择题 若发生液氯泄漏,下列措施中错误的是( )
A.打电活向有关部门报告
B.组织群众往地势较高的地方转移
C.用石灰水喷洒
D.组织群众顺风转移
参考答案:A.液氯泄漏时,群众专业知识淡薄,应打电活向有关部门报告,如消防部门,故A正确;
B.因氯气的密度比空气的大,地势高的地方氯气含量低,则组织群众往地势较高的地方转移,故B正确;
C.氯气能与碱反应,且石灰水碱性较弱,则可用石灰水喷洒,故C正确;
D.氯气能顺风扩散,则不能组织群众顺风转移,故D错误.
故选D.
本题解析:
本题难度:一般