微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化属于化学变化的是?
A.过滤除去水中的泥沙
B.食物腐烂
C.蒸馏法分离酒精与水
D.分液法分离四氯化碳与水
参考答案:B
本题解析:A、过滤过程没有新物质生成,属于物理变化,错误;B、食物腐烂过程有新物质生成,是化学变化,正确;C、蒸馏过程没有新物质生成,属于物理变化,错误;D、分液过程没有新物质生成,属于物理变化,错误,答案选B。
本题难度:简单
2、简答题 一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3?CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如图1所示:
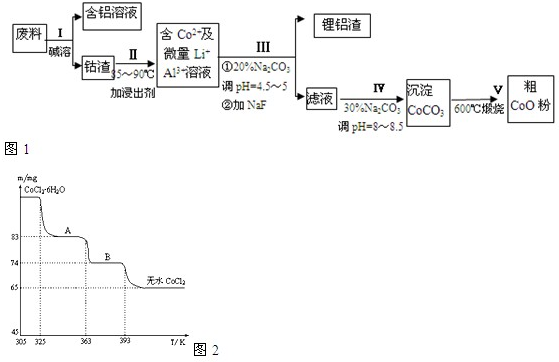
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为______.
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根)______.在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因______.
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式______.
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是______.
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号).
A、c(Na+)=2c(CO32-)
B、c(Na+)>c(CO32-)>c(HCO3-)
C、c(OH-)>c(HCO3-)>c(H+)
D、c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3)
(6)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水.如图是粉红色的CoCl2?6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______.
参考答案:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;盐酸具有还原性,能被Co2O3?CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,
故答案为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3?CoO可氧化盐酸产生Cl2污染环境;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;
故答案为:调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)A.Na2CO3溶液中电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故A错误;
B.碳酸根离子发生水解以及水的电离,所以溶液中离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B正确;
C.碳酸根离子发生水解以及水的电离,所以溶液中离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故C正确;
D.Na2CO3溶液中质子守恒:c(H+)═c(OH-)+c(HCO3-)+2c(H2CO3),故D正确;
故选:BCD;
(6)CoCl2?6H2O~CoCl2
238 130
m65mg
238m=13065mg 解得:m=119mg
A物质的化学式为CoCl2?nH2O,则有:
CoCl2?6H2O~CoCl2?nH2O△m
238 18(6-n)
119mg119mg-83mg
238119mg=18(6-n)119mg-83mg,解得:n=2,
所以A物质的化学式为:CoCl2?2H2O,故答案为:CoCl2?2H2O.
本题解析:
本题难度:一般
3、填空题 卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
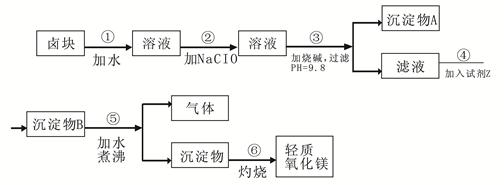
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:?
表1?生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(OH)2
| 9.6
| 11.1
|
?
表2?化学试剂价格表
试剂
| 价格(元/吨)
|
漂液(含NaClO,25.2%)
| 450
|
双氧水(含H2O2 ,30%)
| 2400
|
烧碱(含98% NaOH)
| 2100
|
纯碱(含99.5% Na2CO3)
| 600
|
?
(1)在步骤②中加入漂液而不是双氧水其原因是?。
写出加入NaClO发生反应的离子方程式?。
(2)在步骤③中控制pH=9.8,其目的是?。
(3)沉淀物A的成分为?,试剂Z应该是?。
(4)在步骤⑤中发生反应的化学方程式是?。
(5)若在实验室中完成步骤⑥,则沉淀物必需在?(填仪器名称)中灼烧。
参考答案:(1)漂液比H2O2的价格低得多。(2分)?2Fe2++ClO-+2H+=2Fe3++Cl-+H2O(3分)
(2)使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。(2分)
(3)Fe(OH)3 、 Mn(OH)2、 Mg(OH)2?(2分,写3个且全对得2分,只写其中2个且写对得1分,其他情况都得0分)?纯碱?(2分)
(4)MgCO3 +H 2O?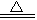 ?Mg(OH)2↓+ CO2↑?(3分,产物写成碱式碳酸镁也算正确)
?Mg(OH)2↓+ CO2↑?(3分,产物写成碱式碳酸镁也算正确)
(5)坩埚?(2分)
本题解析:(1)表2为一个试剂价格表,在漂白液和双氧水均可做氧化剂时,从经济角度应该选漂液更加实惠;因此加入漂白液次氯酸钠后发生的化学反应的离子方程式为
2Fe2+ ?+?ClO-+?2H+?= ?2Fe3+ ?+?Cl-+?H2O。
(2)从表1的离子沉淀PH值可以看出步骤③调节pH值目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。
(3)步骤③调节pH值使除Mg2+以外的各种杂质金属离子都沉淀了,但pH值已略微超过了Mg2+ 开始沉淀的pH值,所以得到的沉淀物A为Fe(OH)3 、 Mn(OH)2,也有 Mg(OH)2 ;沉淀物B在水中加热煮沸可以生成气体,同时又生成沉淀物Mg(OH)2 ,则沉淀物B一定不是Mg(OH)2 ,所以加入的Z物质在表2中只能选纯碱。
(4)加入的Z物质为纯碱,所以生成的沉淀物B是MgCO3,所以沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2 和CO2气体。化学方程式为MgCO3 +H 2O? ?Mg(OH)2↓+ CO2↑ 。
?Mg(OH)2↓+ CO2↑ 。
(5)氢氧化镁灼烧制备氧化镁,应该在耐高温的容器坩埚中进行。
本题难度:困难
4、填空题 (13分)有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
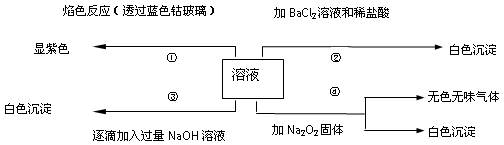 ?
?
在第③个实验中,生成白色沉淀的量与加入NaOH的量有下图所示的相互关系。据此可知:
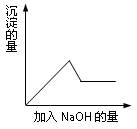
⑴在原溶液中一定不存在的离子有_____________________。
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
?。
参考答案:(13分)
(1)Fe3+、Fe2+、Cu2+、NH4+、CO32-(共3分,写错1个得0分,写对3个得1分,写对4个得2分,写对5个得3分)
(2)KAl(SO4)2(或KAl(SO4)2·12H2O)(2分)? MgSO4(2分)
(3)Mg2++2OH-=Mg(OH)2↓(2分)?Al3++3OH-=Al(OH)3↓(2分)
Al(OH)3+OH-=AlO2-+2H2O(2分)
(如写两个,其中一个是Al3++4OH-=AlO2-+2H2O给2分)
本题解析:略
本题难度:一般
5、选择题 除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
选项
| 混合物
| 试剂
| 分离方法
|
A.
| ?溴乙烷(乙醇)
| 生石灰
| 蒸馏
|
B.
| 甲烷(乙烯)
| 酸性高锰酸钾溶液
| 洗气
|
C.
| 苯(硝基苯)
| 蒸馏水
| 分液
|
D.
| 苯甲酸(NaCl)
| 蒸馏水
| 重结晶
参考答案:D
本题解析:A、生石灰与乙醇不反应,但乙醇与水互溶,溴乙烷不溶于水,用水萃取分液即可,A不正确;B、酸性高锰酸钾溶液能把乙烯氧化生成CO2,引入新的杂质,应该用溴水,B不正确;C、苯和硝基苯均不溶于水,C不正确;D、氯化钠的溶解度受温度影响小,乙醇苯甲酸中含有氯化钠通过重结晶即可,D正确,答案选D。
本题难度:一般
|