|
高中化学知识点总结《化学平衡》答题技巧(2017年最新版)(十)
2017-08-10 00:17:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实,不能用勒夏特列原理解释的是
A.氨水中加酸,NH的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500 ℃左右的温度
|
参考答案:D
本题解析:
试题分析:A.氨水中存在下列平衡:NH3?H2O NH4++OH-,加酸消耗氢氧根离子,平衡正向移动,能解释,A不选;B.对N2(g)+3H2(g) NH4++OH-,加酸消耗氢氧根离子,平衡正向移动,能解释,A不选;B.对N2(g)+3H2(g) 2NH3(g),不断从反应混合物中液化分离出氨气,平衡正向移动,能解释,B不选;C.氯化钠在溶液中完全电离,饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O 2NH3(g),不断从反应混合物中液化分离出氨气,平衡正向移动,能解释,B不选;C.氯化钠在溶液中完全电离,饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O ClO-+2H++Cl-,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以解释,C不选;D.对N2(g)+3H2(g) ClO-+2H++Cl-,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以解释,C不选;D.对N2(g)+3H2(g) 2NH3(g);△H<0,正反应为放热反应,降低温度平衡向正反应方向移动,有利于氨的产率提高,实际上合成氨控制在500 ℃左右的温度,不能解释,D选;选D。 2NH3(g);△H<0,正反应为放热反应,降低温度平衡向正反应方向移动,有利于氨的产率提高,实际上合成氨控制在500 ℃左右的温度,不能解释,D选;选D。
考点:考查勒夏特列原理的使用条件。
本题难度:一般
2、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.A的密度
D.气体总物质的量
参考答案:A、可逆反应:A(s)+2B(g)?C(g)+D(g),反应前后,气体的物质的量不发生变化,体积恒定,反应自开始到平衡,压强都是一定值,故A错误;
B、A是固体,根据质量守恒,随着反应进行,气体的质量在增加,当气体的总质量不发生变化时,说明到达平衡状态,故B正确;
C、无论该反应是否达到平衡状态,A的密度始终不变,故C错误;
④该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,气体的总物质的量始终不变,故D错误.
故选B.
本题解析:
本题难度:一般
3、填空题 (8分)恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g)  C(g) C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的
量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x= mol.
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是  mol. mol.
参考答案: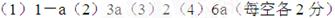
本题解析:略
本题难度:一般
4、简答题 一定温度下,在容积为VL的密闭容器里进行反应:
aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示: bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中 =______.
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:______.
(3)下列叙述能说明上述反应达到平衡状态的是(填序号)______
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
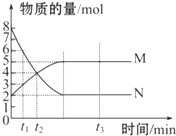
参考答案:(1)有图象可知,ab=△n(N)△n(M)=(8-2)mol(5-2)mol=21,故答案为:21或2;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:v=△c(M)△t=(4-3)molVL(t2-t1)min=1(t2-t1)×vmol?L-1?min-1,故答案为:1(t2-t1)×vmol?L-1?min-1;
(3)A、当体系达平衡状态时,M与N的物质的量之比为可能时1:1,也可能不是1:1,故A错误;
B、根据质量守恒,混合气体的总质量自始至终不发生变化,不能作为平衡状态判断的依据,故B错误;
C、随着反应进行,混合气体的总物质的量减小,当混合气体的总物质的量不随时间的变化而变化时,说明到达平衡状态,故C正确;
D、无论反应是否达到平衡,这个关系总是成立的,反应方向一致,不能作为平衡状态判断的依据,故D错误;
E、该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,说明到达平衡状态,故E正确;
故答案为:CE.
本题解析:
本题难度:一般
5、填空题 (10分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。 SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。
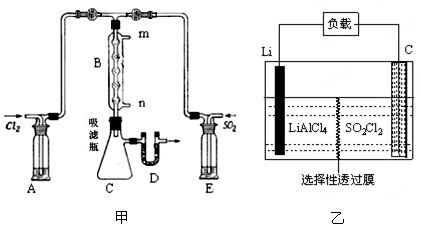
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为 。
②有关题图甲所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.D处U形管中盛放的可以是碱石灰
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(3)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li + SO2Cl2 =" 2LiCl" + SO2↑,则电池工作时,正极的电极反应式为 。
参考答案:(10分,每空2分)(1)2 (2)①MnO2 + 4HCl(浓)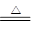 MnCl2 + Cl2 ↑+ 2H2O MnCl2 + Cl2 ↑+ 2H2O
②bd (答对一个得1分,有错无分)
③冷凝SO2Cl2、降温均使平衡右移,有利于SO2Cl2生成(意思对即给分,对一项即给2分)
(3)SO2Cl2 + 2e-=2Cl- + SO2↑
本题解析:(1)根据方程式可知 P元素化合价从0价升高到+5价,失去5个电子。S元素化合价从+6价降低到+4价,所以若生成1molSO2,转移电子的物质的量为2mol。
①浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2 + 4HCl(浓)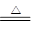 MnCl2 + Cl2 ↑+ 2H2O。 MnCl2 + Cl2 ↑+ 2H2O。
②a.生成的氯气中含有氯化氢,可以用饱和食盐水除杂,但亚硫酸钠能吸收SO2,所以E处洗气瓶中不能盛放饱和Na2SO3溶液,应该用浓硫酸,a错误;b.磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,所以应该防止空气中的水蒸气进入C中,则D处U形管中盛放的可以是碱石灰,b正确;c.B处反应管冷却水应从n接口通入,C错误;d.由于磺酰氯的熔点-54.1℃,沸点69.1℃,所以装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集,d正确,答案选bd。
③由于正方应是放热反应,则反应管通水冷却可以冷凝SO2Cl2、降温均使平衡右移,有利于SO2Cl2生成。
(3)原电池中正极得到电子,则根据方程式可知正极是SO2Cl2得到电子,电极反应式为SO2Cl2 + 2e-=2Cl- + SO2↑。
考点:考查物质制备实验方案设计与探究
本题难度:困难
| 