微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (选修—化学与技术)(15分)
(1)工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体:
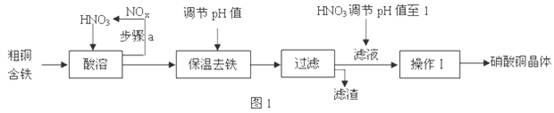
①在步骤a中,还需要通入氧气和水,其目的是?。
②在保温去铁的过程中,为使Fe3+沉淀完全,根据下表数据,溶液的pH值应保持在?范围。调节pH值时,可以向溶液中加入的试剂是(?)
(a) NaOH溶液? (b) 氨水? (c) Cu(OH)2? (d) CuO
?
| 氢氧化物开始沉淀时的pH
| 氢氧化物沉淀完全时的pH
|
Fe3+
Cu2+
| 1.9
4.7
| 3.2
6.7
|
③在操作Ⅰ之前,对滤液用HNO3调节pH值至1,其目的是(结合离子方程式说明)?。
④从滤液中制取硝酸铜晶体的操作Ⅰ的具体步骤是?。
(2)图2是某小组学生查阅资料后所绘出的硝酸铜晶体[Cu(NO3)2 nH2O]的溶解度曲线(温度在300C左右对应不同的晶体),下列说法正确的是(?)
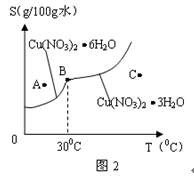
(a) A点时的溶液为不饱和溶液?
(b) B点时两种晶体可以共存
(c)按上述流程最终得到的晶体一定是Cu(NO3)2 3H2O?
(d) 若将C点时的溶液降温至300C以下,可以析出Cu(NO3)2 6H2O晶体
参考答案:(15分)
(1)①将NOx转化为硝酸,提高原料的利用率,减少污染物的排放。(3分)
②3.2——4.7 (2分)? (c 、d) (2分)
③由于铜离子水解:Cu2++ 2H2O?Cu(OH)2 +2H+,加入HNO3能抑制硝酸铜水解(3分)
④蒸发浓缩、冷却结晶、过滤洗涤(3分)
(2)b、d(2分)
本题解析:(1)①氮的氧化物与氧气和水反应生成硝酸,可以循环使用,减少大气污染,所以通入氧气和水的作用是将NOx转化为硝酸,提高原料的利用率,减少污染物的排放。
②根据氢氧化铁完全沉淀时的PH和氢氧化铜开始沉淀时的PH可以确定溶液的PH应该在3.2——4.7之间。调节pH值时,可以向溶液中加入的试剂是氢氧化铜和氧化铜,若加入氢氧化钠和氨水则铜离子也会被沉淀。
③操作1是蒸发结晶,而铜离子在水中会发生水解产生氢氧化铜调节PH为酸性可以抑制水解,离子方程式为?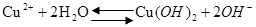
④操作Ⅰ是蒸发结晶,操作步骤为蒸发浓缩、冷却结晶、过滤洗涤。
(2)A点在溶解度曲线之上所以A点是饱和溶液; B点是两种晶体的共存状态,蒸发结晶得到晶体不一定是Cu(NO3)2 3H2O?;根据溶解度曲线可以得出降温至300C以下,可以析出Cu(NO3)2 6H2O晶体。所以选b、d。
本题难度:一般
2、选择题 金属的冶炼有三种方法,那么冶炼银、铁、铝分别应采用
A.热分解法、热还原法、电解法
B.热还原法、热分解法、电解法
C.电解法、热还原法、热分解法
D.电解法、热分解法、热还原法
参考答案:A
本题解析:略
本题难度:简单
3、选择题 从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。
A.氧化→吸收→吹出
B.氧化→吹出→吸收
C.吹出→氧化→吸收
D.吹出→吸收→氧化
参考答案:B
本题解析:从海水中提取溴,先用氧化剂将溴离子氧化为溴单质,再用热空气吹出后用碱液吸收。
本题难度:一般
4、填空题 冶炼金属常用以下几种方法:①以C、CO或H2做还原剂还原 ②以较活泼金属Na、Mg等还原 ③利用铝热反应原理还原 ④电解法 ⑤热分解法
下列金属各采用哪种方法还原最佳。
(1)Fe、Zn、Cu等中等活泼金属________。
(2)Na、Mg、Al等活泼或较活泼金属________。
(3)Hg、Ag等不活泼金属________。
(4)V、Cr、Mn、W等高熔点金属________。
(5)K、Rb、Cs、Ti等金属通常还原方法是________。
参考答案:(1)① (2)④ (3)⑤ (4)③ (5)②
本题解析:选择的方法应以节约原料和降低成本为标准,同时有较高的产率,并易分离。根据每种金属的特点应选择最佳方案。其中(5)K、Rb、Cs、Ti等利用的原理比较特别,不是用活泼金属置换不活泼金属,而是平衡的原理,如Na+KCl NaCl+K,抽离钾蒸气此反应得以继续进行。而Ti是用Na来置换的:
NaCl+K,抽离钾蒸气此反应得以继续进行。而Ti是用Na来置换的:
4Na+TiCl4 4NaCl+Ti或用Mg来置换:2Mg+TiCl4
4NaCl+Ti或用Mg来置换:2Mg+TiCl4 2MgCl2+Ti。
2MgCl2+Ti。
本题难度:一般
5、填空题 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
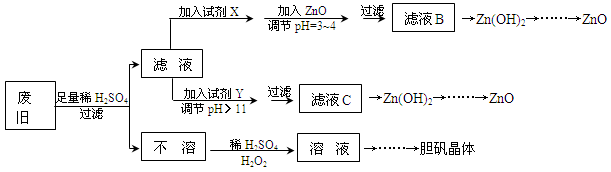
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
?
| Fe3+
| Fe2+
| Zn2+
|
开始沉淀的pH
| 1.1
| 5.8
| 5.9
|
沉淀完全的pH
| 3.0
| 8.8
| 8.9
|
?
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO? B.NaOH C.Na2CO3? D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-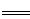 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
参考答案:(1)H2O2(新制氯水等氧化剂,其它合理答案也给分)(1分),将 Fe2+氧化为 Fe3+(2分)
(2)与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去。(2分)
(3)Cu+H2O2+H2SO4 =CuSO4+2H2O(2分)
(4)蒸发浓缩、冷却结晶、抽滤(2分)
(5)B(1分),先产生白色沉淀后溶解(1分)(6)①97.00% (2分)②偏高(2分)
本题解析:(1)废旧黄铜加足量稀硫酸,过滤,滤液中含有Fe2+、Fe3+、Zn2+,不溶物是铜。试剂X的作用是将Fe2+氧化成Fe3+,所以选择绿色氧化剂双氧水。
(2)加入ZnO调节pH=3~4的目的是与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去;
(3)根据不溶物是铜,目的是制备胆矾,写出方程式Cu+H2O2+H2SO4 =CuSO4+2H2O;
(4)从溶液中分离出硫酸铜晶体应为蒸发浓缩、冷却结晶、抽滤;
(5)因为pH>11,Y试剂的目的是让Zn(OH)2全部生成[Zn(OH)4]2-,所以Y试剂选用NaOH,滤液C的主要成分是[Zn(OH)4]2-,逐滴加入盐酸直到过量,跟AlO2-溶液中逐滴加入盐酸直到过量进行类推,所以产生的现象是先产生白色沉淀后溶解;
(6)①2 CuSO4·5H2O? ~? 2Cu2+? ~? I2? ~? 2S2O32-
1.94×10-3mol? 19.40mL×10-3×0.1000mol·L-1?
胆矾晶体的质量 1.94×10-3mol ×250g·mol-1=0.485g
胆矾晶体的纯度为0.485g/0.5000g=97.00%
②因为滴定过程中剧烈摇晃锥形瓶会使一部分滴定液残留在玻璃壁上,导致滴定过程中消耗更多的滴定液,所以测得的纯度也会偏高。
本题难度:一般