微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
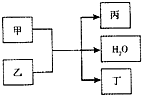
1、简答题 现有甲、乙、丙、丁4种物质,其中甲为单质,其余三种为化合物.转化关系如下:
请回答:
(1)若甲为黄绿色气体,该反应为一工业制备反应,其产品可用于漂白、消毒.
①该反应的化学方程式是______.
②露置于空气中的该产品,加稀盐酸后不可能产生的气体是______(填字母).
a.H2b.Cl2c.CO2
(2)若乙为常见的强酸的浓溶液,丙、丁是均能使澄清石灰水变浑浊的两种气体.
①该反应的化学方程式是______.
②该反应中转移1mol电子时,参加反应的乙是______mol.
参考答案:(1)甲为黄绿色气体,应为Cl2,该反应为一工业制备反应,其产品可用于漂白、消毒,应为氯气和氢氧化钙浊液的反应,反应生成氯化钙和次氯酸钙,
①该反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②露置于空气中的该产品,部分变质生成碳酸钙,加稀盐酸后可生成Cl2和CO2,故答案为:a;
(2)若乙为常见的强酸的浓溶液,丙、丁是均能使澄清石灰水变浑浊的两种气体,该两种气体分别为CO2和SO2,则应为碳和浓硫酸的反应,
①反应的方程式为C+2H2SO4(浓)△.2H2O+CO2↑+2SO2↑,故答案为:C+2H2SO4(浓)△.2H2O+CO2↑+2SO2↑;
②该反应中转移1mol电子时,有0.25molC参加反应,参加反应的乙是0.5mol,故答案为:0.5.
本题解析:
本题难度:一般
2、填空题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
(1)A是______,B是______,C是______(请填写化学式);
(2)反应①的化学方程式______;
(3)反应③的离子方程式______;
(4)反应④的离子方程式______.
参考答案:B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,则
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2?点燃?.?2FeCl3,故答案为:2Fe+3Cl2?点燃?.?2FeCl3;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:一般
3、简答题 以下为中学常见物质,转化关系如下.C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去.
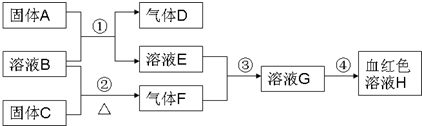
(1)写出固体C化学式______.
(2)实验室用①制取D、B溶液应为______溶液(“浓”或“稀”);若用②制取F,B溶液应为______溶液(“浓”或“稀”).写出②反应方程式______.
(3)如何检验E中的阳离子______.
(4)实验室配制G溶液,操作为______.
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式______.
(6)4gD在空气中完全燃烧生成液体物质时,放出热量为QkJ,写出该反应的热化学方程式______.
参考答案:溶液H为血红色,为Fe(SCN)3,由转化关系可知,溶液G含有Fe3+,由反应③可知,溶液E含有Fe元素,由反应①固体A+溶液B→溶液E+气体D,考虑Fe与酸的反应,A为Fe,B为酸,D为H2,E为亚铁盐,由反应③可知气体F具有强氧化性,结合反应②溶液B+固体C△
本题解析:
本题难度:一般
4、选择题 已知A、B、C、D之间的转化关系A + B → C + D,下列说法不正确的是(?)
A.若A为Fe,D为氢气,则B可能是酸,也可能是水
B.若A、D为化合物,B为水,则C可能是气体单质,也可能是化合物
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D
常温下一定呈液态
参考答案:C
本题解析:A、正确;B、正确;C、反应可能为3NO2+H2O=2HNO3+NO,该反应为氧化还原反应,,错误。 D、正确。
本题难度:一般
5、填空题 已知CO和H2的混合气体称为水煤气,可由碳(C)与水蒸气(H2O)在高温下反应生成.如下图:

已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C为液态.据此,请填空:
(1)氧化物A是______
(2)化合物F是______
(3)反应①的化学方程式是______
(4)反应②的化学方程式是______
(5)反应③的化学方程式是______.
参考答案:根据单质E可作为半导体材料,所以E是硅;C为液态的氧化物,常温下呈液态的氧化物只有水,所以C是水;单质G和H反应生成水,所以单质G和H,所以两种单质中一个是氧气和一个是氢气;氧化物A和单质B反应生成硅和氧化物F,根据元素守恒知,A是二氧化硅;
二氧化硅和单质B反应生成硅和化合物,且F是有毒的氧化物,有毒的氧化物有一氧化碳、一氧化氮、二氧化氮、二氧化硫,且单质B和水能反应生成氧化物F和单质G,结合元素守恒知,B是碳,F是一氧化碳,G是氢气,H是氧气.
(1)通过以上分析知,A是SiO2,故答案为:SiO2;
(2)通过以上分析知,F是CO,故答案为:CO;
(2)碳和二氧化硅在高温下反应生成一氧化碳和硅,故答案为:2C+SiO2?高温?.?2CO+Si;?
(3)碳和水蒸气在高温下反应生成一氧化碳和氢气,故答案为:C+H2O?高温?.?CO+H2;
(4)氢气在氧气中燃烧生成水,故答案为:2H2+O2?点燃?.?2H2O.
本题解析:
本题难度:一般