微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作中,所使用的有关仪器要求干燥的是( )
A.配制一定物质的量浓度溶液时所用的容量瓶
B.氯化铵加热时所用的试管
C.做喷泉实验时用来收集氨气的烧瓶
D.用氯化钠跟浓硫酸反应制氯化氢时所用的反应容器烧瓶
参考答案:C
本题解析:窗体底端
窗体顶端
容量瓶中的少量水不影响溶液的浓度。氨水易挥发,因此制NH3时有少量水不影响NH3的生成。做喷泉实验时烧瓶未干燥(收集NH3时),挤入水后不易产生压强差。
本题难度:简单
2、实验题 (8分)实验室需要配制100 mL 1 mol/L的NaOH溶液,进行了如下操作:
①把称量好的固体NaOH放入小烧杯中,加适量蒸馏水溶解。为加速溶解,可用?
(填仪器名称)搅拌;
②把①所得溶液?后,小心转入? ?(填仪器名称)中;
?(填仪器名称)中;
③继续加蒸馏水至液面距刻度线1—2 cm处,改用?(填仪器名称)
小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻 璃棒2—3次,每次洗涤的液体都要小心转入容量瓶,并轻轻摇匀;
璃棒2—3次,每次洗涤的液体都要小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀。
⑥计算需要NaOH固体的质量:??g
请回答:
(1)正确的操作顺序为? ?(填序号)。
?(填序号)。
(2)取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为?。
(3)若将烧杯中的溶液转移到容量瓶时不慎撒到容量瓶外,其它操作均正确,则最后配成的溶液中溶质的实际浓度比所要求浓度?(填“偏大”、“偏小”)
参考答案:①玻璃棒? ?②冷却到室温,100mL容量瓶?
?②冷却到室温,100mL容量瓶?
③胶头滴管?⑥ 4
(1)⑥①②④③⑤?(2)1 mol/L?(3)偏小?(各1分)
本题解析:略
本题难度:简单
3、选择题 下列有关实验过程中,一般不需要使用玻璃棒进行操作的是(?)
A.蒸发
B.过滤
C.配制一定物质的量浓度的溶液
D.制备氢氧化铁胶体
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列叙述Ⅰ和Ⅱ均正确且有因果关系的是(? )
选项
| 叙述Ⅰ
| 叙述Ⅱ
|
A
| NH4Cl为强酸弱碱盐
| 用加热法除去NaCl中的NH4Cl
|
B
| 溶解度:CaCO3<Ca(HCO3)2
| 溶解度:Na2CO3<NaHCO3
|
C
| SiO2与HF反应
| 氢氟酸不能保存在玻璃瓶中
|
D
| Fe3+具有氧化性
| 用KSCN溶液可以鉴别Fe3+
|
?
参考答案:C
本题解析:A、用加热法除去NaCl中的NH4Cl,是因为NH4Cl加热易分解生成NH3和HCl,与NH4Cl是强酸弱碱盐无关,错误;B、溶解度:Na2CO3 > NaHCO3,错误;C、SiO2与HF反应生成SiF4气体和H2O,玻璃含有SiO2,所以氢氟酸不能保存在玻璃瓶中,正确;D、Fe3+与SCN?发生络合反应,使溶液呈血红色,所以用KSCN溶液可以鉴别Fe3+,与Fe3+具有氧化性无关,错误。
本题难度:一般
5、实验题 (19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
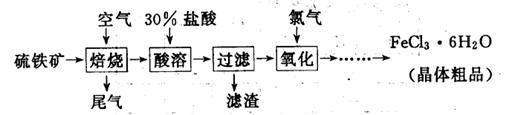
(1)氧化过程中发生反应的离子方程式是?,检验氧化生成的阳离子的试剂是?。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
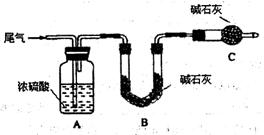
①C仪器的名称是?,该装置的作用是?。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理?,请说明理由?(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是?。
②进行沉淀洗涤的方法是?。
③SO2含量的表达式是?(用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括?、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因? .
6H2O晶体的操作包括?、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因? .
参考答案:(19分)
(1)2Fe2+ + Cl2= 2Cl- + 2Fe3+(2分)? KSCN溶液(1分,其它合理答案也给分)
(2)方案一:①干燥管(1分)?防止空气中的水蒸气、CO2被B装置吸收(2分)
②否(1分)?尾气中的CO2也能被B装置吸收使所测质量分数偏大(2分)
方案二:①使生成的SO42-完全转化为沉淀(2分)?
②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作(2分)
③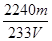 %(2分)
%(2分)
(3)蒸发浓缩(2分)
Fe3+ + 3H2O  ?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解(2分)
?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解(2分)
本题解析:(1)滤液中含有Fe2+,通入Cl2发生氧化还原反应,离子方程式为:2Fe2+ + Cl2= 2Cl- + 2Fe3+;检验Fe3+的试剂为KSCN溶液,若溶液变红,说明含有Fe3+。
(2)方案一:①根据实验装置图可知,C仪器的名称是干燥管;外界空气中含有CO2、水分,可能被B中碱石灰吸收,所以C装置的作用是:防止空气中的水蒸气、CO2被B装置吸收。
②因为尾气中含有CO2,也能办碱石灰吸收,使所测质量分数偏大,所以方案一不合理。
方案二:①溴水与SO2反应生成H2SO4,加入过量的BaCl2溶液,Ba2+与SO42?反应,使生成的SO42-完全转化为沉淀。
②洗涤沉淀的方法是:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作。
③根据化学方程式和S元素守恒可得对应关系:SO2~ BaSO4,所以SO2含量的表达式是:mg÷233g/mol×22.4L/mol÷VL×100% =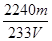 %
%
(3)从FeCl3溶液中得到FeCl3 6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3+ + 3H2O
6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3+ + 3H2O  ?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解。
?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解。
本题难度:一般