微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,对于密闭容器中进行的可逆反应:N2 + 3H2 2NH3,下列说法中,能充分说明这一反应已经达到化学平衡状态的是(?)
2NH3,下列说法中,能充分说明这一反应已经达到化学平衡状态的是(?)
A.N2、H2与NH3的物质的量之比为1︰3︰2
B.N2、H2与NH3的浓度相等
C.各组分的浓度不再发生变化
D.反应停止,正、逆反应速率都等于零
参考答案:C
本题解析:略
本题难度:简单
2、选择题 在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g) N2O4(g),达到平衡后,再向该容器充入a mol NO2,达到平衡后与原平衡比较错误的是(? )
N2O4(g),达到平衡后,再向该容器充入a mol NO2,达到平衡后与原平衡比较错误的是(? )
A.平均相对分子质量增大
B.NO2的转化率提高
C.压强为原来的2倍
D.颜色变浅
参考答案:CD
本题解析:增加NO2,平衡向正方向移动,所以NO2转化率变大,但NO2不可能全部转化为N2O4,压强不可能为原来的2倍,并且剩余c(NO2)变大,故颜色变深。
本题难度:简单
3、选择题 一定量混合气体在密闭容器中发生如下反应:aA(g) + bB(g)  ?cC(g)。该反应达到平衡后,测得A气体的浓度为0.5mol/L。在恒温下将密闭容器扩大到原来的2倍,再次达到平衡后,测的A的浓度为0.3mol/L,则下列叙述正确的是
?cC(g)。该反应达到平衡后,测得A气体的浓度为0.5mol/L。在恒温下将密闭容器扩大到原来的2倍,再次达到平衡后,测的A的浓度为0.3mol/L,则下列叙述正确的是
A.平衡向正反应方向移动
B.a + b < c
C.B的转化率提高
D.C的体积分数降低
参考答案:D
本题解析:在恒温下将密闭容器扩大到原来的2倍的瞬间,A的浓度为0.25mol/L.但最终平衡时A的浓度为0.3mol/L,这说明降低压强,平衡向逆反应方向移动,所以正反应是体积减小的,所以正确的答案选D。
本题难度:一般
4、选择题 进行如下实验,在A锥形瓶中放入10g绿豆大小的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50mL 1mol/L盐酸,下图中能正确表示实验结果的是(?)
(注:x一时间、y-锥形瓶中碳酸钙减少的质量)
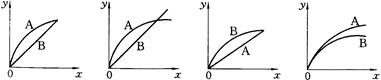
A? B? C?D
参考答案:C
本题解析:盐酸不足,最终产生CO2的量相同,溶解CaCO3的质量也相等,但粉末状的CaCO3与盐酸接触的表面积大,开始的反应速率快,故C选项符合题意。
本题难度:一般
5、填空题 (15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
?
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
|
①上述盐溶液中的阴离子,结合质子能力最强的是?
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是?;
将各溶液分别稀释100倍,pH变化最小的是?(填编号)。
A.HCN?B.HClO?C.C6H5OH?D.CH3COOH ?E.H2CO3
③据上表数据,请你判断下列反应不能成立的是?(填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa? B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO?D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为?
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于?;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为?。
参考答案:⑴? ①k=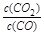 ?;②减小;增大
?;②减小;增大
⑵? ①CO32-;②D;C;③? C D;④2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。⑶ 5; 6。
本题解析:(1)①该反应平衡常数的表达式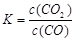 ;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO32-与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO32-。③发生反应时应该是强酸制取弱酸。A.酸性CH3COOH> H2CO3,正确。B.酸性CH3COOH> HCN.正确。C. H2CO3>HClO。正确。D.由于酸性:H2CO3>C6H5OH> HCO3-,所以会发生反应CO2+H2O+C6H5ONa=NaHCO3+C6H5OH。错误。④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。(3)c (Cu2+)·c2(OH-)≥Ksp=2×10-20; c2(OH-)≥2×10-20÷0.02=1×10-18; c(OH-)≥1×10-9;所以pH=5; c(Cu2+)= 0.2 mol/L÷1000=2×10-4mol/L,则c2(OH-)≥2×10-20÷2×10-4mol/L=1×10-16,所以c(OH-)≥1×10-8;pH=6.
;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO32-与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO32-。③发生反应时应该是强酸制取弱酸。A.酸性CH3COOH> H2CO3,正确。B.酸性CH3COOH> HCN.正确。C. H2CO3>HClO。正确。D.由于酸性:H2CO3>C6H5OH> HCO3-,所以会发生反应CO2+H2O+C6H5ONa=NaHCO3+C6H5OH。错误。④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。(3)c (Cu2+)·c2(OH-)≥Ksp=2×10-20; c2(OH-)≥2×10-20÷0.02=1×10-18; c(OH-)≥1×10-9;所以pH=5; c(Cu2+)= 0.2 mol/L÷1000=2×10-4mol/L,则c2(OH-)≥2×10-20÷2×10-4mol/L=1×10-16,所以c(OH-)≥1×10-8;pH=6.
本题难度:一般