微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是?(?)
A.碘和氯化钾
B.金刚石和重晶石
C.二氧化硅和干冰
D.软脂酸甘油酯和冰醋酸
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列化合物中,含有非极性键的离子化合物是
A.Ba(OH)2
B.H2SO4
C.Na2O2
D.CaCl2
参考答案:C
本题解析:A错,Ba(OH)2为含有极性键的离子化合物;B错,硫酸为共价化合物,不是离子化合物;C正确,Na2O2含有非极性键的离子化合物;D错,CaCl2只含有离子键无共价键的离子化合物;
本题难度:一般
3、选择题 下列比较正确的是(?)
A.熔沸点:单晶硅>碳化硅>金刚石
B.熔沸点:MgO>NaCl>KCl
C.熔沸点:Na>Mg>Al
D.熔沸点:O2>I2>Hg
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列晶体中,其中任何一个原子都被相邻的4个原子所包围,以共价键形成正四面体结构,并向空间伸展形成网状结构的是
A.甲烷
B.石墨
C.晶体硅
D.水晶
参考答案:C
本题解析:按题意,该晶体应是原子晶体,而晶体上的质点应为同种原子。在选项中,石墨应为过渡性晶体,水晶(SiO2)为原子晶体,但质点为Si、O不符合条件。
本题难度:一般
5、填空题 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为?。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是?; 1 mol O22+中含有的π键数目为?。氧元素与氮元素能形成多种分子,试写出与N2O分子互为等电子体的一种阴离子?。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为?。
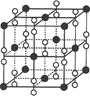
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为?。
参考答案:(12分)(1)F> N> O(2分)?(2)sp(2分) ?2NA(2分)? SCN—(2分)
(3)1s22s22p63s23p63d3(2分)?(4)CaO2(2分)
本题解析:(1)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的,则氮、氧、氟元素的第一电离能从大到小的顺序为F>N>O。
(2)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2。CO2是含有双键的直线型结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气。氮气含有三键,而三键是由1个α键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA。与N2O分子互为等电子体的一种阴离子SCN—。
(3)根据构造原理可知,Cr3+基态核外电子排布式为1s22s22p63s23p63d3。
(4)根据晶胞的结构可知,黑球表示钙离子,其个数=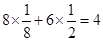 个。阴离子是由2个氧原子构成的,其个数是
个。阴离子是由2个氧原子构成的,其个数是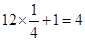 ,所以钙氧化物的化学式是CaO2。
,所以钙氧化物的化学式是CaO2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般