微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)A+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图(1)所示。A的元素符号是___________,与同一个N3-相连的A+有__________个;
(2)如图(2)所示,RCl用作有机机合成催化剂,并用于颜料,?防腐等工业。Cl-的配位数是___________。
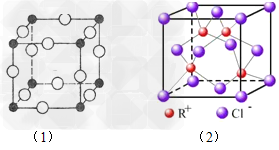
参考答案:(1)Cu?; 6
(2)4
本题解析:
本题难度:一般
2、简答题 请回答下列问题:
(1)羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为______.
(2)科学家通过X射线探明,MgO、CaO的晶体结构与NaCl晶体结构相似(如图所示)
①比较晶体熔点的高低MgO______CaO(填“高于”或“低于”),
②Mg2+的配位原子所构成的立体几何构型为______,③MgCO3晶格能大于CaCO3,为何MgCO3更易分解______.
(3)Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,则Ni最大量吸收H2后,n(Ni):n(H)=______.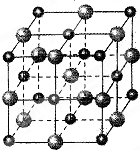
参考答案:(1)由晶体具有常温下为液体,熔沸点低的性质可知,该晶体为分子晶体,故答案为:分子晶体;
(2)①离子晶体中,因镁离子半径小,则晶格能大,所以氧化镁的熔点高于氧化钙的熔点,故答案为:高于;
②以体系为镁离子,六个面的面心为配位原子,则形成空间正八面体结构,故答案为:正八面体;
③碳酸盐分解生成金属氧化物,因镁离子的半径比钙离子的半径小,则氧化镁的晶格能比氧化钙的晶格能大,所以MgCO3更易分解,
故答案为:氧化镁的晶格能比氧化钙的晶格能大;
(3)Ni的堆积与MgO中氧原子堆积相同,O原子占据体心和棱心,晶胞中Ni为1+12×14=4,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,由图可知有个个四面体,则一个晶胞中有8个H,所以Ni最大量吸收H2后,n(Ni):n(H)=4:8=1:2,故答案为:1:2.
本题解析:
本题难度:一般
3、选择题 下列物质的熔沸点依次升高的是(?)
A.Na、Mg、Al
B.Na、Rb、Cs
C.Mg、Na、K
D.铝、硅铝合金、单晶硅
参考答案:A
本题解析:金属键的强弱与离子半径及离子电荷有关,离子半径越小,电荷越多,金属键越强,A、B、C中只有A组熔点升高;合金的熔点应比单组分都低,D错。
本题难度:简单
4、选择题 干冰晶体是一种立方面心结构,即每8个CO2构成立方体,且在6个面的中心又各被一个CO2分子占据,在每个CO2周围最近且等距离的CO2有多少个( )?
A.4个
B.8个
C.12个
D.6个?
参考答案:C?
本题解析:可画出图与CO2等距离的CO2在每个面对角线的中点上,由于晶体是向各方向延伸的,所以同层的CO2等距离的4个,上层4个,下层4个,共12个。?
本题难度:一般
5、选择题
A.O2、I2、Hg? B.CO2、KCl、SiO2
C.Na、K、Rb? D.SiC、NaCl、SO2
参考答案:B
解析:
本题解析:CO2为分子晶体,其分子间作用力很弱,具有较低熔点;KCl为离子晶体,其离子间存在较强的离子键,有较高熔点;SiO2为原子晶体,原子间用较强的共价键相结合,因而熔点很高,所以CO2、KCl、SiO2熔点符合题意。
本题难度:简单