微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)过氧化氢H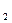 O
O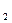 可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H
可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H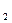 O
O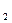 +H
+H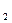 O
O
 +NH
+NH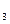 ↑。请完成下列问题:
↑。请完成下列问题:
(1)生成物A的化学式可表示为___________________________。
(2)该反应是氧化还原反应吗?____________。若是,则氧化剂是__________;若不是,请说明理由。
参考答案:(1)KHCO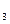 (2)是H
(2)是H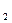 O
O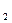
本题解析:根据质量守恒定律,反应前后所参加反应的元素种类和原子总数不变。过氧化氢中的氧呈-1价,在生成物中氧呈-2价,O元素化合价降低,故为氧化剂。
本题难度:简单
2、填空题 (10分)氧化还原反应是重要的一类化学反应。
(1)在化学反应2KMnO4 + 10KI + 8H2SO4=6K2SO4+ 2MnSO4 + 5I2 + 8H2O中,化合价降低的元素是 ?,发生氧化反应的物质是?。
(2)据反应8NH3 + 3Cl2=6NH4Cl + N2回答下列问题:
①该反应中,氧化剂是 ?,还原剂是?。
②该反应中,当有8mol NH3反应时,转移电子总量是?mol。
③参加反应的氧化剂与还原剂的物质的量之比为 ?(最简整数比)。
④当有3mol e- 转移时,该反应生成的氧化产物的质量是?g。
参考答案:(共10分)(1)(2分) Mn(或锰);? KI(或碘化钾)?
(2)(8分)①? Cl2 ;NH3(2分) ②6(2分) ③3:2(2分) ④14(2分)
本题解析:(1)根据反应的化学方程式可知,高锰酸钾中Mn元素的化合价从+7价降低到+2价,所以高锰酸钾是氧化剂;碘化钾中碘元素的化合价从-1价升高到0价,碘化钾是还原剂。
(2)①同样根据反应的化学方程式可知,氨气中氮元素的化合价从-3价升高到0价,失去3个电子,氨气是还原剂;氯气中氯元素的化合价从0价降低到-1价,得到1个电子,氯气是氧化剂。
②根据方程式可知,8mol氨气反应,被氧化的氨气是2mol,转移6mol电子。
③根据方程式可知,8mol氨气反应,被氧化的氨气是2mol,而3mol氯气全部被还原,做氧化剂,因此参加反应的氧化剂与还原剂的物质的量之比为3:2。
④氮气是氧化产物,每生成1mol氮气,转移6mol电子。所以当有3mol e- 转移时,该反应生成的氧化产物氮气的物质的量是0.5mol,质量是0.5mol×28g/mol=14g。
点评:该题是高考中的常见题型和考点,试题难易适中,基础性强,侧重考查学生分析问题、解决问题的能力,有助于培养学生的逻辑思维能力。该题的关键是准确标出有关元素的化合价,然后结合题干信息灵活运用即可。
本题难度:一般
3、填空题 (10分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:? KClO3+? HCl(浓)=? KCl +? ClO2↑+? Cl2↑+?
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性? ②还原性和酸性
③只有氧化性? ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
参考答案:(10分)(1)2? 4? 2? 2? 1? 2? H2O?(4分)
(2) ②(2分)?(3)0.2?(2分)(4)2.63?(2分)
本题解析:(1)根据原子守恒可知,未知物质应该是水。根据方程式可知,氯酸钾中氯元素的化合价从+5价降低到+4价,得到1个电子。氯化钾中氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是2? 4? 2? 2? 1? 2? H2O。
(2)盐酸中氯元素的化合价升高,同时反应后还有氯化钾生成,所以在反应中体现浓盐酸的性质是还原性和酸性,答案选②.
(3)根据配平后的方程式可知,每生成1mol氯气,转移2mol电子,所以产生0.1molCl2,转移的电子的物质的量为0.2mol。
(4)1molClO2的质量是67.5g,得到5mol电子。而67.5g氯气得到电子的物质的量是1.9mol,消毒的效率(以单位质量得到的电子数表示)是Cl2的5÷1.9=2.63倍。
点评:该题的关键是准确判断出氧化产物和还原产物,然后才能依据电子的得失守恒进行有关计算和判断。对于同一种元素的高价态和低价态之间发生的氧化还原反应,在判断氧化产物和还原产物时,有关遵循以下原则。即同一种元素的高价态和低价态之间发生的氧化还原反应时,生成物的价态只能介于中间,且氧化产物的价态不高于还原产物的价态,据此可以进行有关判断和计算。
本题难度:一般
4、选择题 下列叙述正确的是
A.在氧化还原反应中,金属单质一般只作还原剂
B.氧化还原反应中非金属单质一定是氧化剂
C.金属元素被还原时所得产物一定是金属单质
D.某元素从化合态变为游离态,该元素一定被还原
参考答案:A
本题解析:A、金属单质只有正价无负价,在氧化还原反应中只能失电子,作还原剂,正确;B、氧化还原反应中非金属单质不一定是氧化剂,如氯气与水的反应,氯气还是还原剂,错误;C、铁离子被还原时生成亚铁离子,不是单质,错误;D、氯离子从化合态变为游离态氯气,氯元素被氧化,错误,答案选A。
本题难度:简单
5、选择题 水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2H2O,下列说法正确的是
[? ]
A. 硫元素被氧化,铁元素被还原
B.Fe2+、S2O32-都是还原性
C.x=2
D.每生成1 mol Fe3O4,则转移电子数为3 mol
参考答案:B
本题解析:
本题难度:简单