微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 KIO3为白色结晶粉末,溶于水,常温下稳定,833K以上分解.目前KIO3的制备方法有两种:
方法一:电解法.工艺流程如下:
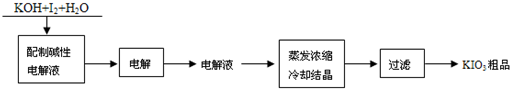
(1)配制碱性电解液的过程中,I2会发生氧化还原反应,生成KIO3和______(填化学式).
(2)电解时,阳极和阴极的电极方程式分别是:
①阳极:______;②阴极:______.
方法二:氯酸钾氧化法.在酸性条件下,将氯酸钾(KClO3)与I2混合,反应后得到KH(IO3)2,再用KOH中和即得KIO3.有关化学反应方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2
(3)KClO3氧化过程中,还原产物为______;每生成6mol?KH(IO3)2,反应中转移的电子为______mol.
(4)与“电解法”相比,“氯酸钾氧化法”的不足之处是(写出两条):
①______②______.
参考答案:(1)由I2会发生氧化还原反应,生成KIO3,I元素的化合价由0升高到+5价,则该反应中I元素的化合价一定降低为-1价,则还生成KI,故答案为:KI;
(2)①碘离子向阳极移动,在阳极上失去电子生成碘酸根离子,阳极反应式为I-+6OH--6e-=IO3-+3H2O,
故答案为:I-+6OH--6e-=IO3-+3H2O;
②在阴极上水中的氢离子放电生成氢气,阴极反应式为2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(3)由反应6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2可知,KClO3为氧化剂,Cl元素的化合价降低,则还原产物为KCl和Cl2,生成6mol?KH(IO3)2时,转移的电子数为5mol×(5+1)+3mol×2×(5-0)=60mol,
故答案为:KCl和Cl2;60;
(4)由反应6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2可知,该反应中生成氯气,污染环境且能腐蚀设备,原料的利用率不高,
故答案为:①生产过程中有氯气产生,易污染环境、腐蚀设备;②KClO3原料利用率不高.
本题解析:
本题难度:一般
2、选择题 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).下列分析一定正确的是( )
A.KSP(PbS)<Kap(CuS)
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-═CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
参考答案:A.难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化,PbS能转化为CuS,所以CuS的溶解度小于PbS的溶解度,故A错误;
B.原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,硫元素化合价升高作还原剂具有还原性;铜蓝中硫元素化合价最低,所以能失电子具有还原性,故B错误;
C.硫化锌难溶于水,所以要写化学式,不能写离子,故C错误;
D.原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,所以存在氧化还原反应;CuSO4与ZnS反应生成硫化铜和硫酸锌是复分解反应,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 只有氧化性的离子是( )
A.Cl-
B.Fe2+
C.MnO4-
D.S2-
参考答案:A.Cl-中Cl元素化合价处于最低价态,只具有还原性,故A错误;
B.Fe2+化合价处于中间价态时,既具有氧化性也具有还原性,故B错误;
C.MnO4-化合价处于最高价态时,只具有氧化性,故C正确;
D.S2-化合价处于最低价态时,只具有还原性,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
参考答案:A、Cl2+H2O=HCl+HClO反应中既有化合价升高的氯元素也有化合价降低的氯元素,所以在氧化还原反应中可能同一元素既被氧化又被还原,故A错误;
B、2H2O?通电?.?2H2↑+O2↑,反应中氢气被氧化,氧气被还原,所以某元素从化合态变成游离态时,该元素可能被氧化也可能被还原,故B错误;
C、第ⅣA元素中的C元素既不易失电子又不易得电子,故C错误;
D、有单质参加和有单质生成的化学反应如3O2═3O3,不属于氧化还原反应,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 联氨(N2H4)可作火箭的燃料,燃烧时反应为2N2H4+2NO2=3N2+4H2O.下列说法错误的是( )
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭飞行
C.N2H4的摩尔质量为32g/mol
D.此反应中N2H4作氧化剂
参考答案:A、此反应中N元素有化合价的变化,所以是氧化还原反应,故A正确;
B、该反应是一个放热反应,反应瞬间产生大量高温气体,推动火箭进行,故B正确;
C、N2H4的分子量是32,所以其摩尔质量为32g/mol,故C正确;
D、该反应2N2H4+2NO2=3N2+4H2O中,N2H4→N2,N元素由-2价→0价,失电子,所以N2H4作还原剂,故D错误.
故选D.
本题解析:
本题难度:一般