微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。


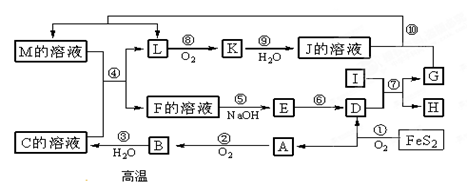
请填写下列空白:
⑴ 在周期表中,组成单质G的元素位于第____________周期_________族。
⑵ 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
⑶ 在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
⑷ 反应④的离子方程式是:__________________________________。
⑸ 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_________________________。
参考答案:(1)四(或4);Ⅷ(2分)?(2)1:2(2分)?(3)③(2分)?
(4)3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O(2分)?
(5)Fe2O3+3KNO3+4KOH =2K2FeO4+3KNO2+2H2O(2分)
本题解析:I是由第三周期元素组成的单质中熔点最高的金属,则I一定是铝。K是一种红棕色气体,所以K是NO2。因此L是NO。NO2溶于水又生成硝酸和NO,所以J是硝酸。FeS2燃烧生成氧化铁和SO2,所以A是SO2,则D是氧化铁,氧化铁和铝发生铝热反应生成氧化铝互溶单质铁。根据反应⑩可知,反应是氧化还原反应,所以G是铁,H是氧化铝。SO2氧化生成三氧化硫,则B是三氧化硫,三氧化硫溶于水生成硫酸,因此C是硫酸。根据反应④可知,该反应是氧化还原反应,所以M应该是硝酸亚铁,则F是铁盐,所以E是氢氧化铁,氢氧化铁分解生成氧化铁。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、选择题 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是?
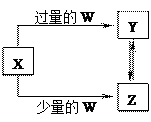
选项
| W
| X
|
A
| 盐酸
| Na2CO3溶液
|
B
| Cl2
| Fe
|
C
| CO2
| Ca(OH)2溶液
|
D
| NaOH
| AlCl3溶液
参考答案:
B
本题解析:
选项B中不论Cl2过量与不足,与金属Fe反应的产物均为FeCl3,因此不能形成题中所示的回路。
本题难度:一般
3、填空题 (12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙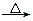 丙+丁+水。 丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为? ?。 ?。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g)?△H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g)?△H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:? ?。 ?。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是?。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4- + MnO4- +  SO2 + SO2 +  ??= ??=  Mn2+ + Mn2+ +  SO42- + SO42- +  H+ H+
③SO2在一定条件下,发生:2SO2(g)+O2(g)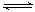 2SO3(g)?△H< 0反应。该反应的化学平衡常数K=?(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是?(填序号)。 2SO3(g)?△H< 0反应。该反应的化学平衡常数K=?(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是?(填序号)。

a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
参考答案:
(1)①C +4HNO3(浓)=CO2 +4 NO2 +2H2O
②N2H4(g) +O2(g)= N2(g)+ 2H2O(g)?△H=-534kj.mol-1
(2)①蓝色晶体变白色粉末?②2MnO4- +5SO2 +2H2O =2Mn2+ +5SO42- +4H+
③K=C2(SO3)/C2(S O2)*C(O2)??C? O2)*C(O2)??C?
本题解析:略
本题难度:困难
4、填空题 在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).

回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是______.
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则反应①的离子方程式是______.
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是______.
(4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是______.
(5)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是______.
参考答案:E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)设该反应转移电子的物质的量xmol
2Na2O2+2H2O=4NaOH+O2↑? 转移电子数
? 22.4L? 2mol
?2.24L? x
?x=0.2mol,故答案为:0.2mol;
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,A是氯气,与碱反应,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,C、D是二氧化碳和二氧化硫,E为水,所以C、D、E是浓硫酸和碳反应的产物,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O;
(4)B是一种酸式盐,且B遇盐酸有气体产生,所以B可能是碳酸氢盐或亚硫酸氢盐或硫氢化物.A是一种常见一元强碱,B是一种酸式盐,D是一种气体,强碱与酸式盐反应生成气体,该气体是氨气,所以A、B的反应是强碱和碳酸氢铵或亚硫酸氢铵或硫氢化铵的反应,
故答案为:2OH-+NH4++HCO3-?△?.?NH3↑+2H2O+CO32-(或2OH-+NH4++HSO3-?△?.?NH3↑+2H2O+SO32-2OH-+NH4++HS-?△?.?NH3↑+2H2O+S2-);
(5)B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,所以B是偏铝酸钠,A是一种强酸,酸先和偏氯酸钠反应生成氢氧化铝,氢氧化铝和过量的酸反应生成铝离子,故答案为:AlO2-+4H+=Al3++2H2O.
本题解析:
本题难度:一般
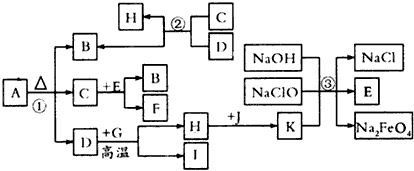
5、推断题 下图是物质A-K的相互转变关系图。已知A是由原子个数比为1:2:4的三种常见元素组成的化合物,在隔绝空气下A加热分解得到等物质的量的B、C、D三种氧化物;常温下B、C、F是无色气体,J为黄绿色气体,G、H为常见金属单质,部分反应条件未注明。
请回答:
(1)A的化学式___________。
(2)H元素在元素周期表中的位置_____________
(3)写出C与E反应的化学方程式并注明条件_________________
(4)写出反应②的化学方程式__________________。
(5)反应③可在溶液中进行,其离子方程式为_________________
(6)请列举两例说明D+G反应原理在生产中的应用: ①_____________②_______________。
参考答案:(l)FeC2O4
(2)第四周期Ⅷ族
(3)CO+H2O(g)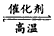 CO2+ H2 CO2+ H2
(4) FeO+ CO Fe + CO2 Fe + CO2
(5)2Fe3++3ClO- +10OH-=2FeO42-+3Cl- +5H2O
(6)①焊接钢轨;②冶炼高熔点金属(钒、铬、锰等)
本题解析:
本题难度:一般
|