微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:?。
(2)下列三种情况下,离子方程式与 (1)相同的是?(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
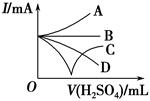
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的?(填序号)曲线表示。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将?。
参考答案:(1)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O (2)A (3)C (4)下沉
本题解析:(1)向Ba(OH)2溶液中逐滴加入稀硫酸,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,离子方程式为:Ba2++OH-+SO42-+H+=BaSO4↓+H2O;向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量,反应的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O。(3)向Ba(OH)2溶液中缓缓加入稀硫酸,当Ba(OH)2与H2SO4恰好完全反应时,溶液导电能力接近为零,再加过量稀硫酸,溶液导电能力又增强,故曲线C正确。(4)Ba(OH)2与H2SO4反应过程中,随反应的进行,溶液密度变小,塑料小球下沉。
本题难度:一般
2、选择题 离子方程式:CO32- + 2H+ ="=" H2O + CO2中的CO32-代表的物质是
A.CaCO3
B.NaHCO3
C.BaCO3
D.Na2CO3
参考答案:D
本题解析:A、C均为难溶物,不可拆;B拆出HCO3-,故选D;
本题难度:简单
3、判断题 判断下列电离方程式的正误。
(1)BaSO4=Ba2+ +SO42- ( )
(2) H2CO3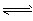 2H++CO32- ( )
2H++CO32- ( )
(3)H2S=H++HS- ( )
(4)NaHSO4=Na++H++SO42- ( )
(5)NaHCO3=Na++H++CO32- ( )
(6)CH3COOH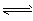 CH3COO-+H+ ( )
CH3COO-+H+ ( )
(7)CaCl2=Ca2+ +Cl2- ( )
(8) HCO3- H++CO32- ( )
H++CO32- ( )
(9)Al(OH)3 Al3+ +3OH- ( )
Al3+ +3OH- ( )
参考答案:(1)√
(2)×
(3)×
(4)√
(5)×
(6)√
(7)×
(8)√
(9)√
本题解析:
本题难度:一般
4、选择题 下列反应的离子方程式不正确的是
[? ]
A.铁与稀盐酸反应:2Fe+6H+==2Fe3++3H2↑
B.氢氧化钠溶液与盐酸反应:OH-+H+==H2O
C.锌与硫酸铜溶液反应:Zn+Cu2+==Zn2++Cu
D.氯化钡溶液与稀硫酸反应:Ba2++SO42- ==BaSO4↓
参考答案:A
本题解析:
本题难度:一般
5、实验题 (12分)某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中。
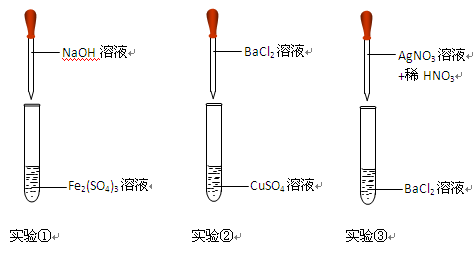
编号
| 现象
| 离子方程式
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
参考答案:
编号
现象
离子方程式
①
有红褐色沉淀生成
Fe3++3OH-==Fe(OH)3↓
②
有白色沉淀生成,溶液为蓝色
Ba2+ + SO42-="=" BaSO4↓
③
有白色沉淀生成,滴加稀硝酸,沉淀不溶解
Ag++ Cl-="=" AgCl↓
本题解析:略
本题难度:简单
|