微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.杂化轨道可以参与π键的形成
B.杂化前后的轨道数不变,但轨道的形状发生了改变
C.共价键都有方向性
D.基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、6种电子运动状态
参考答案:B
本题解析:杂化轨道只能用于形成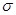 键或用来容纳未参与成键的孤电子对,A不正确;氢气分子中的共价键没有方向性,C不正确;基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、11种电子运动状态,选项D不正确,答案选B。
键或用来容纳未参与成键的孤电子对,A不正确;氢气分子中的共价键没有方向性,C不正确;基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、11种电子运动状态,选项D不正确,答案选B。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。试题紧扣教材,针对性强,有利于培养学生的应试能力,提高学生的学习效率。
本题难度:一般
2、实验题 (14分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
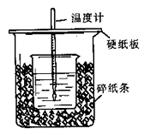
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
参考答案:(1)环形玻璃搅拌棒
(2)减少实验过程中的热量损失
(3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关
(5)偏小
本题解析: (1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)盐酸和氢氧化钠中和热的热化学方程式为:HCl(aq)+NaOH(aq)=H2O(l)△H="-57.3" kJ?mol-1,故答案为:HCl(aq)+NaOH(aq)=H2O(l)△H="-57.3" kJ?mol-1;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小.
考点:中和热的测定。
本题难度:一般
3、选择题 下列离子组在指定溶液中能大量共存的是
A.pH=11的溶液:Na+、Cu2+、SO42-、Cl-
B.含有大量AlO2-的溶液:Na+、K+、OH-、NO3-
C.加入Al能放出H2的溶液:Br-、HCO3-、Ca2+、NH4+
D.与Cu反应能产生气体的溶液:Fe3+、Fe2+、SO42-、Cl-
参考答案:B
本题解析:分析:A.pH=11的溶液显碱性;
B.含有大量AlO2-的溶液,显碱性;
C.加入Al能放出H2的溶液,为酸或强碱溶液;
D.与Cu反应能产生气体的溶液,为强氧化性酸溶液.
解答:A.pH=11的溶液显碱性,Cu2+、OH-结合生成沉淀,则不能共存,故A错误;
B.含有大量AlO2-的溶液,显碱性,该组离子之间不反应,能大量共存,故B正确;
C.加入Al能放出H2的溶液,为酸或强碱溶液,HCO3-既能与酸反应又能与碱反应,则不能共存,故C错误;
D.与Cu反应能产生气体的溶液,为强氧化性酸溶液,与Fe2+发生氧化还原反应,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确习题中的信息及离子之间的反应是解答的关键,注意选项D中的氧化还原反应,题目难度不大.
本题难度:一般
4、选择题 下列与化学反应能量变化相关的叙述不正确的是
A.化学反应是旧键断裂和新键形成的过程
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同