微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A 化学键断裂过程中放出热量
B 化学键形成过程中需要吸收热量
C 在一个确定的化学反应中,反应物的总能量与生成物的总能量可能相等
D 化学反应除了生成新的物质外,还伴随着能量的变化
参考答案:D
本题解析:考查化学反应中能量变化的原因。从宏观的角度分析,若反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。从微观的角度分析,如果断键吸收的能量高于形成化学键所放出的能量,则反应是吸热反应,反之是放热反应。所以选项D是正确的。
本题难度:一般
2、填空题 (6分)下表中是一些化学键键能的数据
化学键
| Cl-Cl
| Br-Br
| I-I
| H-Cl
| H-Br
| H-I
| H-H
|
键能(kJ/mol)
| 243
| 193
| 151
| 432
| 366
| 298
| 436
|
根据上述数据回答(1)~(3)题
(1)下列物质本身具有的能量最低的是
A.H2 B.Cl2 C.Br2 D.I2
(2)X2 + H2 = 2HX(X代表卤族原子)的反应是 反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是 。
参考答案:(6分)(1)A (2)放热 (3)F2
本题解析:(1)化学键键能指断裂1mol化学键所需的能量,键能越大,物质越稳定,所具有的能量越低,H-H键能最大,H2具有的能量最低;(2)以氯气为例,Cl-Cl键键能243kJ/mol,H-Cl键键能432kJ/mol,H-H键键能436 kJ/mol,Cl2 + H2 =" 2HCl" △H =-185kJ/mol,是放热反应;(3)从卤素单质及氢化物的键能变化可以看出,F2与氢气反应放出的热量最多。
考点:反应热与键能的关系
本题难度:一般
3、选择题 下列离子在水溶液中,无色且能大量共存的是
A.Fe3+、K+、NO3-、Cl-
B.Ba2+、K+、Cl-、OH-
C.H+、Mg2+、HCO3-、SO42-
D.Na+、K+、MnO4-、NO3-
参考答案:B
本题解析:分析:有色离子不能存在于无色溶液中,能发生离子反应的离子不能共存于同一溶液中.
解答:A、三价铁离子属于有色离子,在物色溶液黄总不能共存,故A错误;
B、不存在有色离子和能发生反应的离子,故B正确;
C、碳酸氢根离子和氢离子会发生反应生成二氧化碳和水,不能共存于一溶液中,故C错误;
D、高锰酸跟离子是紫红色的离子,在无色溶液中不能共存,故D错误.
故选B.
点评:本题考查离子的共存问题,熟悉离子的性质及离子之间的反应即可解答,难度不大.
本题难度:一般
4、填空题 (8分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备气态甲醛。甲醛与气态甲醇转化的能量关系如图所示:
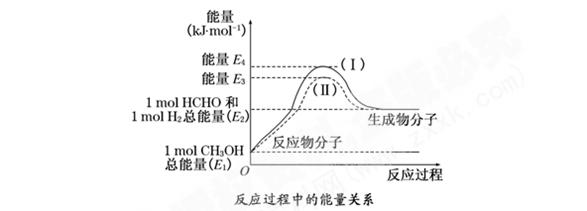
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应.
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,理由是  。
。
(3)合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
T1、T2、T3的大小关系为
参考答案:(共8分)
(1)吸热(2分)
(2)相同(2分) 一个化学反应的反应热仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关(2分)
(3)T1>T2>T3(2分)
本题解析:略
本题难度:一般
5、选择题 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是
[? ]
A.Q1 + Q2 >Q3
B.Q1 + Q2 >2Q3
C.Q1 + Q2 <Q3
D.Q1 + Q2 <2Q3
参考答案:D
本题解析:
本题难度:一般