|
高考化学知识点总结《电解池原理》高频考点巩固(2017年模拟版)(二)
2017-08-10 00:37:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去。下图为电解装置示意图(电极材料分别为铁和石墨):
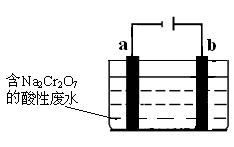
请回答:
(1)装置中的b电极是 (填“阳极”或“阴极”)。
(2)a电极的电极反应式是 。
(3)完成b电极附近溶液中反应的离子方程式:
Cr2O72-+6Fe2++14H+=2 +6 +7
(4)电解时用铁不用石墨做阳极的原因是 。
(5)电解结束后,若要检验电解液中还有Fe2+存在,可选用的试剂是 (填字母)。
A.KSCN溶液
B.CuCl2溶液
C.H2O2溶液
D.K3[Fe(CN)6]
|
参考答案:(8分)
(1)阳极 (1分)
(2)2H++2e-=H2↑ (2分)
(3)Cr3+ Fe3+ H2O (2分,全对才给分)
(4)Fe作阳极,可产生还原剂Fe2+,而石墨作阳极不能提供还原剂 (2分)
(5)D (1分)
本题解析:(1)装置中的b电极连接电源的正极,则b电极为阳极。
(2)a电极为电解的阴极,溶液中的H+得电子,电极方程式为:2H++2e-=H2↑
(3)Cr2O72?把Fe2+氧化为Fe3+,Cr2O72?被还原为Cr3+,根据元素守恒同时生成H2O,所以生成物为:Cr3+、Fe3+、H2O。
(4)除去Cr2O72?需要还原剂Fe2+,Fe作阳极,可产生还原剂Fe2+,而石墨作阳极不能提供还原剂。
(5)K3[Fe(CN)6]与Fe2+反应生成蓝色沉淀,所以用K3[Fe(CN)6]检验Fe2+。
考点:本题考查电解原理及应用、电极方程式的书写、离子的检验。
本题难度:一般
2、计算题 在500mLCuSO4溶液中插入两根电极,一极为铁,另一极为含杂质锌均匀的粗铜,通电一段时间后,切断电源,立即将电极取出,这时铁极上析出7.04g铜,电解液增重0.02g。求粗铜中锌的质量分数。
参考答案:18.4%(6分)
本题解析:铁极析出铜,发生还原反应,为阴极:Cu2++2e-=Cu
而粗铜为阳极:Zn=2e-=Zn2+? Cu=2e-=Cu2+
铁极质量的增加是由于反应:
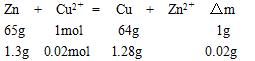
故当阴极有1.3g锌溶解时,同时阴极溶解的铜为7.04-1.28=5.76g
故粗铜中锌的质量分数为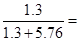 18.4% 18.4%
本题难度:一般
3、填空题 如何设计A、B、C、D分别符合下述要求:
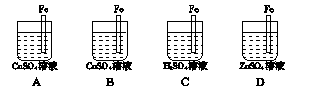 ? ?
(1)A中Fe棒不溶解但质量增加?。
(2)B中Fe棒溶解,但Cu不在Fe上析出?。
(3)C中Fe棒不溶于H2SO4?。
(4)D中ZnSO4浓度不变?。
参考答案:(1)可插入Zn片用导线与Fe相连(或外接电源,Fe作阴极)
(2)插入比Fe不活泼的金属并用导线与Fe相连(或外接电源,Fe作阳极)
(3)插入Zn片,用导线与Fe相连(或外接电源,Fe作阴极)
(4)插入Zn片,外接电源,Fe作阴极
本题解析:根据原电池和电解池的电极反应来分析。
本题难度:简单
4、选择题 某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于?水.当K闭合时,SO42-从右向左通过交换膜移向A极.下列分析正确的是?

[? ]
A.溶液中c(A2+)减小
B.B极的电极反应:B-2e-===B2+
C.Y电极上有H2产生,发生还原反应
D.反应初期,X电极周围出现白色胶状沉淀
参考答案:D
本题解析:
本题难度:一般
5、选择题 用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的PH下降的是
[? ]
A.CuSO4
B.AgNO3
C.BaCl2
D.H2SO4
参考答案:AB
本题解析:
本题难度:一般
|