微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ( 8 分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,c、d为两个铂片,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:

(1)电源A上的a为_____极
(2)滤纸B上发生的总化学方程式为:_______________________________?
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e上发生的反应为:____________? ____ ,C中盛放的电镀液可以是______溶液。
参考答案:(1) 正(1分)(2) 2NaCl+2H2OCl2↑+H2↑+2NaOH (2分)
(3) Cu-2e-=Cu2+ (2分)? CuSO4(1分)
本题解析:略
本题难度:一般
2、填空题 (10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称

已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  ?Pb+PbO2+4H++2SO42-
?Pb+PbO2+4H++2SO42-
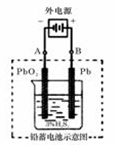
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g。请回答下列问题:

①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
参考答案:(1)左 精铜 右 粗铜 硫酸铜溶液? Ag、Au
(2)Pb PbO2 B
(3)①4OH――4e-=2H2O+O2↑? ②0.005mol/L 2
本题解析:考查电化学原理的应用
(1)粗铜精炼时,粗铜和电源的正价相连,作阳极。纯铜和电源的负极相连,作阴极,电解质溶液是硫酸铜溶液。纯铜中含有的杂质铁和镍的活泼性均强于铜的,所以二者首先失去电子。银和金的活泼性弱于铜的,在铜存在的条件下,二者不可能失去电子,二者最终形成阳极泥。
(2)根据装置图可判断A和电源的负极相连,作阴极,得到电子发生还原反应,电极反应式
为PbSO4+2e-=Pb+SO42-。B和电源的正极相连,作阳极,失去电子发生氧化反应,电极反应式为PbSO4-2e-+ 2H2O = PbO2 + 4H+ +SO42-。所以A极生成铅,B极生成二氧化铅,因此蓄电池的正负极的极性将对换,即B将是正极。
(3)根据溶液显蓝色,以及析出红色的固态物质可判断,该固态物质一定是铜,铜;离子在阴极达到电子,析出铜单质,电极反应式为Cu2++2e-=Cu。则B极是阳极,且生成的气体是无色的,所以是溶液中OH―放电,失去电子,发生氧化反应生成氧气,电极反应式为4OH――4e-=2H2O+O2↑。电极增重0.16 g,即铜是0.16g,物质的量为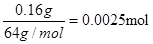 ,所以原溶液的浓度为
,所以原溶液的浓度为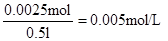 。每消耗1mol铜离子,则同时生成2mol氢离子,所以氢离子的浓度为0.005mol/L×2=0.11mol/L,因此pH=2。
。每消耗1mol铜离子,则同时生成2mol氢离子,所以氢离子的浓度为0.005mol/L×2=0.11mol/L,因此pH=2。
本题难度:一般
3、填空题 下图为细菌冶铜和火法冶铜的主要流程。
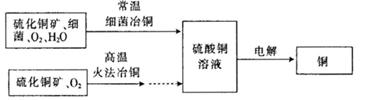
(1) 硫酸铜溶液一般呈________(填“酸”、“碱”或“中”)性,原因是________? (用离子方程式表示)。写出电解硫酸铜溶液的化学方程式:______________(电解过程中,始终无氢气产生)。
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺。细菌冶铜与火法冶铜相比,优点为________________(写出一点即可)。

(3) 用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液。电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液。而电解硫酸铜溶液时,没有棕褐色溶液生成。下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?________(填“正确”或“不正确"),原因是__________
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的 Fe元索)的物质的颜色比单一价态的物质的颜色要深。
资料2:
CuCl微溶于水,能溶于浓盐酸。
②猜想:棕褐色溶液中可能含有的离子是________(填3种主要离子符号)。
③验证猜想:完成实验方案(配制棕褐色溶液)。
取少量________固体于试管中,加入________使其溶解,再加入________溶液,观察现象。
④已知电解前,U形管中加入了________100mL0.5 mol . L-1 CuCl2溶液,电解结朿时电路中一共转移了 0.03 mol电子,且阴极生成0. 64 g铜,则形成的低价阳离子的物质的量为________mol。
参考答案:
(1)酸(1分);Cu2++2H2O Cu(OH)2+2H+(1分);2CuSO4+2H2O
Cu(OH)2+2H+(1分);2CuSO4+2H2O 2H2SO4+2Cu+O2↑(2分)
2H2SO4+2Cu+O2↑(2分)
(2)节约能源、环保、设备简单、操作方便.工艺条什易控制、投资少、成本低(或适宜处理贫矿、废矿、尾矿、炉渣等)(或其他合理答案)(2分)
(3)①不正确(1分);阴极不会产生氯气(2分)
②Cu2+、Cu+、Cl-、[CuCl2]-(只要写前三个即可)(2分)
③氯化亚铜;浓盐酸;氯化铜(所加|式剂顺序不对扣1分)(各1分)
④0.01(2分)
本题解析:该题分为两部分,前一部分是课本上知识内容的应用,比较简单,后一部分为对新现象的探究,有一定难度。探究题在解答的过程中要注意对新信息的收集和联系课本已有知识,进行整合。在电解过程中阳离子向阴极移动,阴离子向阳极移动,故在阴极上不可能生成氯气。根据新信息,多价态混合物质比单一物质颜色深,结合铜有+1、+2两个价态,可以进行相关猜测;然后根据CuCl的性质(溶于浓HCl)进行设计方案,探究。计算可以根据守恒法:生成0.01molCu,得到0.02mol电子,还有0.03=0.02=0.01mol电子为Cu2+得到电子生成Cu+,故生成Cu+为0.01mol。
本题难度:困难
4、选择题 下列关于电解池的叙述不正确的是(?)
A.在电解池的阴极发生还原反应
B.与电源负极相连的是电解池的阳极
C.电解质溶液中的阴离子移向电解池的阳极
D.电子从电源的负极沿导线流入电解池的阴极
参考答案:B
本题解析:与电源负极相连的电极为电解池的阴极。
本题难度:简单
5、填空题 (4分)阿伏加德罗常数(NA)、物质的量(n)和粒子数(N)之间有如下关系:NA=N/n,测定阿伏加德罗常数有多种方法,其中电解法(根据电子的物质的量和电子数来测定NA)是常用的方法。试回答下列有关问题:
(1)实验室有相同浓度的NaCl、CuSO4、AgNO3、H2SO4等溶液,若实验过程中用惰性电极电解,且不考虑电极上的析出物与电解质溶液之间的反应,则你认为选择哪一种溶液作为电解质,实验既简便,测定结果误差又小,并说明理由。
(2)采用你所选定的溶液来实验,至少应测定__________个数据。它们是___________。
(3)若已知一个电子的电荷量,(符号为q),选定符号代表有关数据,列出电解法求阿伏加德罗常数(NA)的数学表达式___________________________________________。
参考答案:(1)选用AgNO3溶液较好。①若电解NaCl、H2SO4溶液,产生气体的体积较难测定准确。②在同样条件下,通过等量的电量,析出Ag的质量远大于Cu,因而称量和计算时产生的误差前者要小。
(2)3电流、电解(通电)时间、电解产物的质量
(3)ItM (Ag)/ qm(Ag)
本题解析:(1)由于电解过程中,两极及电路中通过的电荷量相等,因此只要测定两极析出物质的物质的量即可,在实际测量过程中,气体的体积较难测定,故一般不选NaCl、H2SO4,而CuSO4、AgNO3两种物质在通过相等的电荷量时,析出Ag的质量远大于Cu,称量和计算时前者产生的误差小,故应选AgNO3作电解液为好。(2)由(1)的分析已知,采用电解AgNO3方法时,应称取阴极析出银的质量,而电荷量Q=It,故还应测定电路中的电流及电解时间。
(3)设析出Ag的质量为m(Ag),电流为I,电解时间为t,则 NA=N(e-)/n(e-)= ?=ItM(Ag)/qm(Ag)。
?=ItM(Ag)/qm(Ag)。
本题难度:简单