微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.现有八种微粒:Na、Mg2+、Fe2+、Fe3+、S2-、SO2、HCl、H2O,从元素化合价的角度分析,其中只有氧化性的是______?,只有还原性的是_____?_,
既有氧化性又有还原性的是__________?_。
Ⅱ.已知能用氯酸钾与浓盐酸反应制取氯气,其化学方程式如下:
KClO3+6HCl=KCl+3Cl2↑+ 3H2O
⑴用单线桥在上述方程式中标出电子转移的方向和数目。
⑵标况下生成3.36LCl2,转移电子的物质的量为?,被氧化的盐酸与未被氧化的盐酸质量之比为?。氧化产物与还原产物物质的量之比为?。
参考答案:Fe3+,Mg2+(1分);? Na, S2ˉ(1分);? Fe2+,SO2,HCl,H2O(1分);
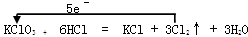 (线桥1分,电子数1分,共2分)
(线桥1分,电子数1分,共2分)
0.25mol(1分);? 5:1(1分);? 5:1(1分)
本题解析::Ⅰ.Na, S2ˉ均为元素的最低价,则只具有还原性,
Fe3+,Mg2+均为元素的最高价,则只具有氧化性,
Fe2+,SO2,HCl,H2O处于中间价态元素的离子既有氧化性又有还原性。?
Ⅱ.(1)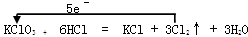
(2)标况下生成3.36LCl2,Cl2的物质的量为n="V/Vm" =3.36L/(22.4L/mol)=0.15mol,则反应的HCl的物质的量为0.3mol,转移电子的物质的量为5/6×0.3mol=0.25mol;化合价升高和化合价未变的物质量之比为5:1,所以被氧化的盐酸与未被氧化的盐酸质量之比为5:1。氧化产物与还原产物物质的量之比为5:1。
本题难度:一般
2、填空题 (8分)二氧化硒(Se)是一种氧剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方式?。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是? ?。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O
Se+I2+KNO3+H2O
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为?。
参考答案:
 (1)? Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(1)? Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)? H2SO4(浓)> SeO2> SO2。
(3)
(4)? 92.5%
本题解析:考查氧化还原反应的有关判断和计算等。
(1)根据已知反应物和生成物并根据电子得失守恒和质量守恒定律可知,反应的化学方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应氧化剂的氧化性大于氧化产物的,所以根据反应的化学方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> SO2。
(3)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的方程式是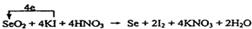 。
。
(4)根据反应①②及电子的得失守恒可知,SeO2~4Na2S2O3,所以参加反应的SeO2的物质的量是0.2000 mol·L-1×0.025L/4=0.00125mol,因此所测定的样品中SeO2的质量分数为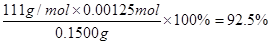 。
。
本题难度:一般
3、实验题 某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: ?能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论:?。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
实验编号
| 蒸馏水
| 淀粉溶液
| KI固体
| 稀KOH溶液
| 一段时间后观察实验现象
|
1
| 30mL
| 2 mL
| 5g
| 0滴
| 试管中出现了蓝色
|
2
| 29.5 mL
| ?
| 5g
| 10滴
| 试管中出现了很浅的淡蓝色
|
3
| 29 mL
| 2 mL
| ?
| 20滴
| 试管中无明显变化
|
4
| ?
| 2 mL
| 5g
| 30滴
| ?
|
?
注:1滴溶液体积为0.05mL。
(3)小组同学通过实验证实了在酸性条件下KI都能被氧气氧化,现继续探究酸性强弱与氧化难易的关系。有同学提出假设,认为酸性越强越容易被氧化。请设计实验验证假设,完成下表中内容。
可供选择的药品有:KI固体、淀粉溶液、0.005mol/L H2SO4、0.5mol/L H2SO4。
实验方案(不要求写具体过程)
| 预期实验结果和结论
|
?
| ?
|
?
参考答案:
假设4:在一定pH范围内(1分,合理表述均给分)
(1)碘单质只有在pH大于一定值时才能和碱性溶液反应(1分,合理表述均给分)
(2)
实验编号
蒸馏水
淀粉溶液
KI固体
稀KOH溶液
一段时间后观察实验现象
1
?
?
?
?
?
2
?
2mL
?
?
?
3
?
?
5g
?
[]
4
28.5 mL
?
?
?
试管中无明显变化
?
(3)
实验方案(不要求写具体操作过程)
预期实验结果和结论
在编号为①②③的试管中分别加入0.005mol/L H2SO4、0.05mol/L H2SO4、0.5mol/L H2SO4各30mL,然后再向三只试管中分别加入2mL淀粉溶液、5g KI固体(2分)
若都出现蓝色,且①②③试管中颜色依次加深,则酸性越强越容易被氧化,假设正确。否则,假设错误。
(1分)
本题解析:结合题目前后的实验探究过程,可得出假设4为在一定pH范围内能被氧化。
(1)实验现象说明碱性较弱时,碘单质不会和碱发生反应
(2)根据变量控制的思想,不难填充表格中的数据,第4组中KOH滴加得最多,碱性最强,可推知试管中也无明显变化。
本题难度:一般
4、填空题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是?。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
参考答案:(1)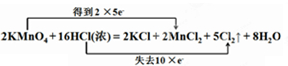 (2分)
(2分)
(2)6.02×1023或NA;1mol?(每空2分)?(3)160g(4分)
本题解析:(1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价,得到5个电子;氯元素化合价从-1价升高为0价,失去1个电子,所以双线桥表示为: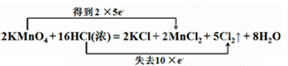 ;(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若生成标准状况下11.2L 氯气,物质的量=11.2L÷22.4L/mol=0.5mol;生成5molCl2,转移电子为10mol,所以生成0.5mol氯气转移转移电子为1mol,其个数是6.02×1023或NA;16molHCl反应,其中被氧化的HCl为10mol;生成氯气物质的量为5mol,所以0.5mol氯气生成,被氧化的HCl为1mol。(3)参加反应的氯化氢的物质的量是1.6mol其质量=1.6mol×363.5g/mol,所以需消耗36.5%的浓盐酸的质量为1.6mol×363.5g/mol÷36.5%=160g。
;(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若生成标准状况下11.2L 氯气,物质的量=11.2L÷22.4L/mol=0.5mol;生成5molCl2,转移电子为10mol,所以生成0.5mol氯气转移转移电子为1mol,其个数是6.02×1023或NA;16molHCl反应,其中被氧化的HCl为10mol;生成氯气物质的量为5mol,所以0.5mol氯气生成,被氧化的HCl为1mol。(3)参加反应的氯化氢的物质的量是1.6mol其质量=1.6mol×363.5g/mol,所以需消耗36.5%的浓盐酸的质量为1.6mol×363.5g/mol÷36.5%=160g。
本题难度:一般
5、选择题 ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3 +H2C2O4 + H2SO4==2ClO2↑+ K2SO4 +2CO2↑+2H2O,下列说法正确的是
A.KClO3在反应中得到电子
B.1mol KClO3参加反应有2mol电子转移
C.ClO2是氧化产物
D.H2C2O4在反应中被氧化
参考答案:AD
本题解析:略
本题难度:简单