微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质具有强氧化性的是(? )
①氯化氢? ②过氧化氢? ③乙酸? ④过氧乙酸? ⑤氧化钠? ⑥过氧化钠
A.①②③④
B.③④⑤⑥
C.①③⑤
D.②④⑥
参考答案:D
本题解析:含过氧键的小分子都具有强氧化性。
本题难度:简单
2、选择题 向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的
A.滴加KI溶液时,转移2mol e-时生成1mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
参考答案:D
本题解析:溶液变为棕色,说明反应中有单质碘生成。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色,进一步验证了碘的存在。因为碘能把SO2氧化生成硫酸和碘化氢。因此硫酸铜和碘化钾反应的化学方程式是2CuSO4+4KI=2CuI↓+I2+2K2SO4,所以转移2mol e-时生成2mol白色沉淀,A不正确;B不正确,体现的是SO2的还原性;C不正确,单质碘是氧化剂;根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,选项D正确,答案选D。
点评:凡是有元素化合价升降的反应都是氧化还原反应,所以准确标出有关元素的化合价变化情况,是判断的根本。而氧化还原反应中的计算,则需要依据电子的得失守恒进行。
本题难度:一般
3、填空题 (8分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发
如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_________________。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
?NaBiO3+?MnSO4+??H2SO4— ?Na2SO4+?Bi2(SO4)3+?NaMnO4+?H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是?
参考答案:(1)溶液由无色变为紫色? 0.25? (2)Cl2
(3)10? 4? 14?= 3? 5? 4? 14?(2)Bi2(SO4)3
本题解析:(1)由于MnO4-在溶液中显紫红色,所以现象是溶液由无色变为紫色;还原剂是Mn2+,化合价从+2价升高到+7价,所以失去5个电子;氧化剂中S的化合价从+7价降低到+6价,得到1个电子,所以1mol氧化剂得到2mol电子,因此若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量0.25mol。
(2)由于在反应中氯离子也能被氧化,所以还生成氯气。
(3)根据方程式可知,Bi的化合价从+5价降低到+3价,得到2个电子。MnSO4中Mn的化合价从+2价升高到+7价,失去5个电子,所以氧化剂是NaBiO3,还原剂是MnSO4,二者的物质的量之比是5︰2,其中还原产物是Bi2(SO4)3,氧化产物是NaMnO4,因此方程式为
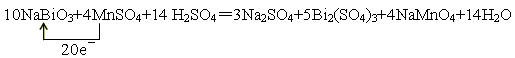
本题难度:一般
4、选择题 已知中学化学中常见反应形式为: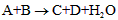 ,对于该反应的下列叙述不正确的是
,对于该反应的下列叙述不正确的是
[? ]
A.该反应可能是氧化还原反应
B.该反应可能是非氧化还原反应
C.C和D有一种一定是盐
D.A和B不一定是酸或碱
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列不属于缓慢氧化的是
A.铁生锈
B.酿酒
C.食物腐烂
D.蜡烛燃烧
参考答案:D
本题解析:
本题难度:简单