微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:?
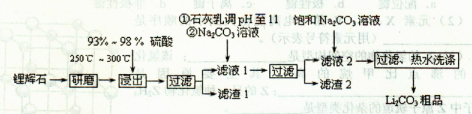
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)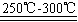 Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓
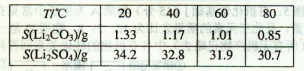
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
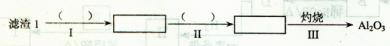
则步骤I中反应的离子方程式是?,步骤Ⅱ应通入一种气体试剂为?,步骤II反应完之后需要的操作是?。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示)?。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是?。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是?。
②b中,生成Li2CO3反应的化学方程式是?。
参考答案:(1)Al2O3 +6H+ = 2Al3++3H2O(2分) NH3 (2分) 过滤(2分)
(2)Ca(OH)2 + 2H+ = Ca2+ + 2H2O(1.5分)Ca(OH)2(s) + Mg2+ Mg(OH)2(s) +Ca2+(1.5分)
Mg(OH)2(s) +Ca2+(1.5分)
(3) Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(2分)
(4)① 2Cl-―2e-=Cl2↑(2分)② 2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O(2分)
本题解析:本题考查元素化合物的性质及化学与技术有关知识。(1)用酸将Al2O3溶液解,再通入氨气转化为Al(OH)3沉淀,过滤后灼烧得到Al2O3,步骤I中反应的离子方程式是Al2O3 +6H+ = 2Al3++3H2O,通入的气体物质是NH3,步骤II反应完之后需要的操作是过滤。(2)向滤液l中加入石灰乳的作用是调节溶液的pH值并将Mg2+转化为难溶的Mg(OH)2沉淀,反应的离子方程式为Ca(OH)2 + 2H+ = Ca2+ + 2H2O,Ca(OH)2(s) + Mg2+ Mg(OH)2(s) +Ca2+。(3)从表中数据可知,Li2CO3的溶解度随温度升高而减小,故用热水洗涤能减少Li2CO3的损失,保证更高的产率。(4)①Li2CO3溶于盐酸,得到LiCl溶液,电解时,阳极Cl-失电子被子氧化,电极反应式为2Cl-―2e-=Cl2↑,Li+通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH4HCO3,将LiOH转化为Li2CO3,反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O。
Mg(OH)2(s) +Ca2+。(3)从表中数据可知,Li2CO3的溶解度随温度升高而减小,故用热水洗涤能减少Li2CO3的损失,保证更高的产率。(4)①Li2CO3溶于盐酸,得到LiCl溶液,电解时,阳极Cl-失电子被子氧化,电极反应式为2Cl-―2e-=Cl2↑,Li+通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH4HCO3,将LiOH转化为Li2CO3,反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O。
本题难度:简单
2、填空题 氢氧化钠是一种用途十分广泛的化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是__________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽的①电解时电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来的2倍的是________________。
参考答案:(1)阳极产生的Cl2不易腐蚀钛 既能防止H2、Cl2混合爆炸,又能避免Cl2与NaOH反应
(2)abd (3)②
本题解析:电解时H+、Cl-分别在阴阳两极上得失电子,产生H2和Cl2,阳极材料必须选择不易被Cl2腐蚀的材料;增大面积、提高温度、增大电压都有利于加快电解食盐水的速率。当电解时电压增大到原来的2倍,电解池的电阻可能发生变化,电解时的电流强度不一定增大到原来的2倍;电解时温度从30 ℃提高到60 ℃,电解池的内阻会有所降低,但并不一定恰好降低为原来的一半;当电解时的电流强度增大到原来的2倍,单位时间内流过电路的电量恰好为原来的2倍,发生反应的物质的量也恰好为原来的2倍,即反应速率为原来的2倍。
本题难度:一般
3、选择题 光导纤维是一种现代化的通讯工具,制造光导纤维的主要原料是
[? ]
A.CaCO3
B.SiO2
C.CaO
D.Na2CO3
参考答案:B
本题解析:
本题难度:简单
4、填空题 (12分)I:能源是人类生活和社会发展的基础,地球上最基本的能源是? ▲?,大自然利用这一能源最成功的是? ▲?。氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水。)请写出氢气燃烧的热化学方程式? ▲?。
Ⅱ:理论上任意一个自发的氧化还原反应都能设计成原电池,现有如下反应:
2FeCl3 + Cu = 2FeCl2 + CuCl2
如果将其设计成原电池,请写出负极材料及正极电极反应式。
负极材料:? ▲?;正极电极反应式:? ▲?。
III:工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出工业用电解熔融氧化铝制取铝的化学方程式:? ▲?。
(2)现冶炼2.7 t 铝,需要转移电子的物质的量为? ▲?mol。
参考答案:(4分) ②、①、④、③(每空1分)
本题解析:略
本题难度:一般
5、选择题 下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是
A.加热Al2O3
B.加热CaCO3
C.电解熔融NaCl
D.氯化钠与铝粉高温共热
参考答案:C
本题解析:A、铝是活泼的金属,只能通过电解法冶炼,因此电解熔融的氧化铝可以获得金属铝,A不正确;B、钙是活泼的金属,只能通过电解法冶炼。加热碳酸钙分解生成氧化钙和CO2,B不正确;C、钠是活泼的金属,只能通过电解法冶炼,因此电解熔融的氯化钠可以得到钠,C正确;D、钠是活泼的金属,且活泼性强于铝,金属铝与氯化钠不可能发生铝热反应,D不正确,答案选C。
本题难度:一般