微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)="4.5" mol·L-1,反应均需要搅拌60min。
编号
| 温度/℃
| 加入某盐
| H2SO4体积/mL
| H2O体积/mL
| 铝粉加入量/g
| 铝粉溶解量 /g
|
①
| 20
| 不加
| 40
| 0
| 2.0050
| 0.0307
|
②
| 80
| 不加
| 40
| 0
| 2.0050
| 0.1184
|
③
| t1
| 不加
| 20
| V1
| 2.0050
| ﹨
|
④
| t2
| 5 mL0.01 mol·L-1
CuSO4溶液
| 20
| V2
| 2.0050
| ﹨
|
(1)实验①和②的目的是??。
为了获得铝粉溶解量,还需要测量的数据是??。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ?℃,V1= ??mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ?℃,V2= ??mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 ??。
参考答案:(1)其它条件不变,温度对稀硫酸溶解铝粉量的影响。?(2分)
反应60min后剩余铝粉的质量?(2分)
(2)20?;20?(2分,各1分)
(3)20?;15?(2分,各1分)
加入硫酸铜,铝置换出少量的铜构成铝铜原电池,加快反应速率。(2分)
本题解析:⑴实验①和②的实验温度不同,目的是探究温度对稀硫酸溶解铝粉量的影响;由总质量减去剩余铝粉的质量可确定溶解量;
⑵实验①和③是为了研究硫酸的浓度对该反应的影响,则温度应相同(20℃),但浓度不同,根据总体积相同,则V1=20mL;
⑶实验③和④是为了研究加入CuSO4溶液对该反应的影响,则温度、浓度应相同,因加入5mL 0.01mol?L-1CuSO4溶液,则加水的体积应为15mL,加入硫酸铜,铝置换出铜,可形成铝、铜原电池反应,从而加快反应速率。
本题难度:一般
2、选择题 亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……(?)。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……(?)。
A.逸出ClO2使生成物浓度降低
B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用
D.溶液中的Cl-起催化作用
参考答案:D
本题解析:向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,而盐酸于稀硫酸的不同之处在于酸根,这说明反应中生成的氯离子对反应起到催化剂的作用,答案选D。
点评:该题主要是考查学生对已知信息的提炼、归纳、总结和应用的能力,有利于培养学生的创新思维能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力,属于中等难度的试题。
本题难度:一般
3、选择题 影响化学反应速率的因素很多,下列措施能使化学反应速率减小的是( )
A.降低温度
B.升高温度
C.增大压强
D.增大反应物浓度
参考答案:A.降低温度化学反应速率减小,故A选;
B.升高温度化学反应速率加快,故B不选;
C.增大压强化学反应速率加快,故C不选;
D.增大反应物浓度,化学反应速率加快,故D不选;
故选A.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
①为加快锌粉与稀硫酸制氢气的反应速率,可以加入少量的CuCl2固体
②面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
③2molSO2与1molO2混合反应后一定能生成2molSO3
④煤的干馏、石油的裂化、乙烯生产聚乙烯均属于化学变化
⑤压缩天然气、液化石油气这两类燃料的主要成分都是烃类.
A.①②③④⑤
B.②③④⑤
C.①③④⑤
D.①②④⑤
参考答案:①加入少量的CuCl2固体,锌置换出铜,可形成原电池反应,加快反应速率,故①正确;
②表面积越大,反应速率越大,故②正确;
③为可逆反应,2mol SO2与1mol O2混合反应后生成SO3的物质的量小于2mol,故③错误;
④煤的干馏生成粗苯、煤焦油等,为化学变化,石油裂化生成烯烃,为化学变化,乙烯生成聚乙烯,发生加聚反应,为化学变化,故④正确;
⑤压缩天然气、液化石油气都为烃类物质的混合物,故⑤正确.
故选D.
本题解析:
本题难度:简单
5、简答题 (思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气量减少.
实验三、将不纯的锌片与稀盐酸反应,发现反应速率加快.
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快.
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是______,t2~t3速率变化的主要原因是______.
(2)实验二放出氢气量减少的原因是______.
(3)某同学认为实验三和四反应速率加快原因,均因为原电池的存在,你认为是否正确,若不正确,说明原因.若正确写出原电池的电解质溶液、正、负极材料及电极反应.
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液
实验三
Zn
杂质
Zn-2e-=Zn2+
2H++2e-=H2↑
盐酸
实验四
Zn
Cu
Zn-2e-=Zn2+
2H++2e-=H2↑
盐酸
|
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液
实验三
Zn
杂质
Zn-2e-=Zn2+
2H++2e-=H2↑
盐酸
实验四
Zn
Cu
Zn-2e-=Zn2+
2H++2e-=H2↑
盐酸
|
.
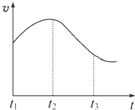
参考答案:(1)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢;
故答案为:纯锌与稀盐酸反应,放出热量,温度升高;随着反应进行c(H+)降低
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少;
故答案为:锌片与FeCl3反应,导致与盐酸反应的锌的质量减少
(3)实验三、实验四构成原电池的本质都是发生反应Zn+2HCl=ZnCl2+H2↑,
实验三、Zn发生氧化反应,负极材料是Zn,负极电极反应式为Zn-2e-=Zn2+,正极是比锌不活泼的杂质,H+在正极发生还原反应,正极电极反应式为2H++2e-=H2↑,电解质溶液是盐酸;
实验四、Zn发生氧化反应,负极材料是Zn,负极电极反应式为Zn-2e-=Zn2+,Cu是正极材料,H+在正极发生还原反应,正极电极反应式为2H++2e-=H2↑,电解质溶液是盐酸.
故答案为:
负极材料正极材料负极反应式正极反应式电解质溶液实验三Zn杂质Zn-2e-=Zn2+2H++2e-=H2↑盐酸实验四ZnCuZn-2e-=Zn2+2H++2e-=H2↑盐酸
本题解析:
本题难度:一般