微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体中既不能用浓硫酸干燥,又不能用固体NaOH干燥的是
[? ]
A.Cl2
B.O2
C.SO2
D.H2S
参考答案:D
本题解析:
本题难度:简单
2、选择题 过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是?。
 ?
?
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是:?。
A. BaO 2 + H2SO 4 ="==" BaSO4 ↓ + H2O2
B. 2NH4HSO4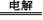 (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
D.乙基蒽醌法:
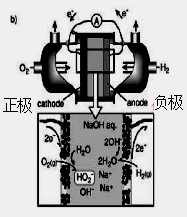
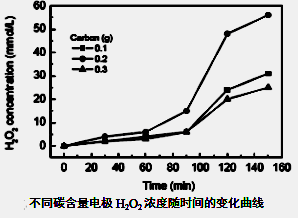
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
 ?
?
下列说法正确的有?。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜:?。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚:?。
参考答案:
(1)B(2)D(3)ABCD (4)①Cu+H2SO4+H2O2=CuSO4+2H2O;
②H2O2 +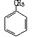
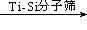
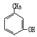 +H2O;
+H2O;
本题解析:
本题考查过氧化氢的制备。(2)D选项的物质可以循环利用,原子利用率最高;(3)从曲线可以看出,0~90minH2O2含量不高,90min后增大较快,A选项正确;120min后,生成速率减慢,说明生成与分解逐渐趋向平衡,B选项正确;正极反应为:H2O+O2+2e-=HO2-+OH-,生成的HO2-结合H+后产生H2O2,C选项正确;从三个曲线比较来看,正极含碳的质量0.2g时,H2O2的产率最高,D选项正确。(4)H2O2作为强氧化剂。
本题难度:一般
3、填空题 某同学用10mol·L—1的浓盐酸配制250mL 1 mol·L—1的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸?mL。(2分)
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
?等。(2分)
(3)取所配制的稀盐酸100mL与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为多少克?(写出计算过程)(3分)
(4)设反应后溶液的体积仍为100mL,则反应后溶液中H+物质的量浓度是多少?(写出计算过程)(3分)
参考答案:(1) 25mL?(2分)
(2)250ml容量瓶 胶头滴管?(2分)
(3)2.6g?(3分)
(4)0.2 mol·L—1(3分)
本题解析:略
本题难度:简单
4、选择题 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是
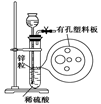
①食盐水?②KNO3溶液?③适量稀硫酸铜溶液
④Na2CO3溶液?⑤CCl4?⑥浓氨水
A.①③⑤
B.①②③
C.④⑤⑥
D.①②③⑤
参考答案:A
本题解析:略
本题难度:一般
5、填空题 (10分)制备溴苯的实验装置如右图所示,回答下列问题:
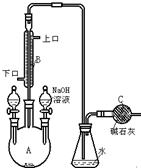
(1)反应开始前已向仪器A中加入的药品是?。?
装在左侧分液漏斗中的药品是?。
(2)将左侧分液漏斗的旋纽打开后,在A中可观察到的现
象是?。
(3)冷凝管B有上、下两口,冷却水应从?口进入。
(4)右侧分液漏斗中的物质在什么时间加入A中?
?。其作用是?。
(5)要证明该反应是取代反应,最方便的实验方法是?。
参考答案:(1)铁粉(或三溴化铁)(1分);苯、液溴(只写一个不给分)(1分)
(2)瓶内开始时液面有轻微跳动,慢慢剧烈起来,瓶中出现红棕色气体(2分)
(3)下(2分)
(4)反应结束时(1分);除去未反应的溴 (1分)
(5)反应后,取锥形瓶中液体,滴加AgNO3溶液,若产生浅黄色沉淀则得证。(2分)
本题解析:略
本题难度:简单