微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列实验装置及现象,可以得到相应结论的是?(?)
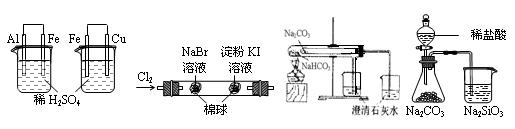
图1?图2?图3?图4
?
| 实验现象
| 结论
|
A.
图1左烧杯中铁表面有气泡,右烧杯中铜表面有气泡
活动性:Al>Fe>Cu
B.
图2左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C.
图3左边烧杯变浑浊,右边烧杯不变浑浊
热稳定性:Na2CO3>NaHCO3
D.
图4锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
|
题型:单选题难度:中档来源:不详 答案 本题实际是从物质的性质、实验装置、实验原理等方面对实验进行评价的考查。图1左烧杯中形成的原电池铝作负极,铁作正极,活动性Al>Fe,右烧杯中形成的原电池铁作负极,铜作正极,活动性Fe>Cu,A项正确;图2可能是过量的氯气将KI氧化,该项不能证明氧化性Br2>I2,B项错误;图3中Na2CO3应放在大试管中,NaHCO3应放在小试管中,C项错误;图4所用稀盐酸不是氯元素的最高价氧化物的水化物,故D项错误。
马上分享给同学