微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验操作正确的是
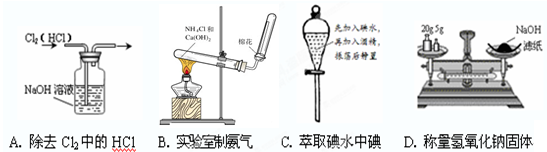
参考答案:B
本题解析:A、氢氧化钠也吸收氯气,应该用饱和食盐水,A不正确;B、实验室制备氨气利用熟石灰与氯化铵混合加热,采用向上排空气法收集,B正确;C、酒精与水互溶,不能用作萃取碘水中的碘,可以用四氯化碳或苯,C不正确;D、托盘天平称量氢氧化钠固体是应该用小烧杯,且是左物右码,D不正确,答案选B。
本题难度:简单
2、选择题 下列基本实验操作正确的是(? )?
A 稀释浓硫酸时将水沿器壁缓慢注入浓硫酸中,同时不断搅拌,防止酸液溅出
B 过滤时,滤纸的边缘要高于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下
C 胶头滴管的尖嘴部分直接伸入试管里滴加液体,避免液体溅出到试管口上
D 实验室取用液体药品做性质实验时,如果没有说明用量,一般取1~2ml
参考答案:D
本题解析:A错,稀释浓硫酸时将浓硫酸沿器壁缓慢注入水中,同时不断搅拌,防止酸液溅出;B错,过滤时,滤纸的边缘要低于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下;C错,胶头滴管的尖嘴部分不能直接伸入试管里滴加液体,以免沾污试剂;D正确;
本题难度:简单
3、选择题 下列实验操作或实验事故处理正确的是?
[? ]
A.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中
B.实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸
C.实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗
D.实验室制乙酸丁酯时,用水浴加热
参考答案:A
本题解析:
本题难度:简单
4、填空题 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
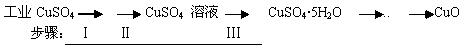
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
⑴ 步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是________、________。
⑵ 步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式____________________________。
②调整pH 的范围应该在____________之间。
⑶ 步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,_____________,水浴加热烘干。采用水浴加热的原因是____?。
⑷ 该同学用CuSO4溶液进行如下探究实验:取A、B两支试管,分别加入 2 mL? 5%H2O2溶液,再向H2O2溶液中分别滴入0.1 mol·L-1 FeCl3和CuSO4溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确________(填正确或错误),请说明原因?。
(5)16克硫酸铜固体投入水中形成1升溶液,则该溶液显?性(填“酸性”或“碱性”或“中性”),溶液中所有阳离子总数?0.1NA(填“等于”或“大于”或“小于”),若在上述新配制溶液加入稀硫酸再加入铁片产生氢气速率会明显加快,原因是?;室温下、若在上述新配制溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时c(Cu2+)=________________mol·L-1(Kap[Cu(OH)2]=2.2×10-20)。
参考答案:(17分)⑴ 溶解(2分)、过滤(2分)?⑵①2Fe2++H2O2 +2H+=2Fe3++2H2O(3分)?②3.7-6.0(2分)
⑶ 冷却结晶(2分)?防止CuSO4·5H2O晶体分解(2分)
⑷ 错误 (1分)?根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率(2分)
(5)酸性?大于 形成原电池? 2.2×10-8
本题解析:(1)步骤Ⅰ的目的是除不溶性杂质,所以所需操作的名称是溶解和过滤。
(2)①双氧水具有氧化性,能把亚铁离子氧化生成铁离子,则H2O2溶液除去硫酸亚铁的离子方程式是2Fe2++H2O2 +2H+=2Fe3++2H2O。
②氢氧化铜开始沉淀的pH是6。0,氢氧化铁完全沉淀的pH是3.7,所以调整pH 的范围应该在3.7~6.0之间。
(3)溶液加热蒸发至有晶膜出现时,停止加热,然后冷却结晶即可。水浴加热便于控制温度,可以防止CuSO4·5H2O晶体分解。
(4)根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率,所以结论是错误的。
(5)硫酸铜溶于水,铜离子水解,溶液显酸性。由于1个铜离子水解生成2个氢离子,所以溶液中阳离子总数是增加的。铁能和硫酸铜发生置换反应,生成铜,从而构成原电池,加快反应速率。溶液的pH=8,则溶液中OH-的浓度是10-6mol/L,则根据氢氧化铜的溶度积常数可知,溶液中c(Cu2+)=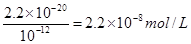 。
。
点评:该题是高考中的常见题型,难度大,对学生的要求高。有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、选择题 根据实验目的判断下列实验操作或装置正确的是
[? ]
A. 
B.?
C. 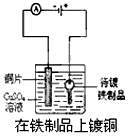
D. 
参考答案:D
本题解析:
本题难度:一般