微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室为妥善保存硫酸亚铁溶液,常加入少量的
A.锌粉
B.铜片
C.铁片
D.镁粉
参考答案:C
本题解析:硫酸亚铁溶液中亚铁离子会发生水解,且易被氧气氧化为铁离子,所以妥善保存硫酸亚铁溶液时为了防止氧化可加入少量的铁粉,同时为了防止亚铁离子水解可加入少量稀硫酸;
本题难度:简单
2、选择题 向一定量Fe、FeO和Fe2O3的混合物中加入120 mL 4mol·L-1的稀硝酸恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。?若用足量的H2在加热条件下还原相同质量的混合物,能得到铁的物质的量为
A.0.14mol
B.0.16mol
C.0.21mol
D.0.24m
参考答案:A
本题解析:往所得溶液中加入KSCN溶液,无红色出现,则溶液中无Fe2+,根据溶液中N元素质量守恒n(HNO3)="n(NO)+" n(NO3-),知n(NO3-)=0.42mol。所以溶液中n(Fe2+) =0.21mol,有铁元素的质量守恒能得到铁的物质的量为0.21mol。C正确。
本题难度:简单
3、选择题 随着人们生活节奏的加快方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品变潮及富脂氧化变质,在包装袋中应放入的化学物质是
[? ]
A.无水CuSO4、蔗糖?
B.硅胶、硫酸亚铁
C.食盐、FeSO4?
D.生石灰、食盐
参考答案:B
本题解析:
本题难度:简单
4、选择题 铁和铁的合金是生活中常用的材料,下列说法正确的是( )
A.一定条件下,铁粉可与水蒸气反应
B.不锈钢是铁的合金,只含金属元素
C.铁与盐酸反应,铁的合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
参考答案:A
本题解析:A 对,在高温下能反应
B 错不锈钢中还含有非金属元素碳元素
C 错 铁和铁的合金都可与盐酸反应
D 错 镀锌铁板,锌做负极,铁做正极,所以,镀锌铁板比铁板更耐腐蚀
本题难度:简单
5、实验题 草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________;?假设二:全部是FeO ;?假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
实验步骤
| 现象与结论
|
步骤1:向试管中加入少量固体产物,再加入足量?,充分震荡
| 若溶液颜色明显改编,且有?生成,则证明有铁单质存在
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色
| ?
|
步骤3:去步骤2得到少量固体与试管中,滴加
?
| ?
|
?
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
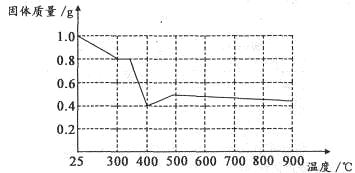
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。?
参考答案:Ⅰ:(1)全部是Fe
(2)
实验步骤
现象与结论
步骤1:硫酸铜溶液
(暗)红色固体
步骤3:过量HCl,静置,取上层清液,滴加几滴KSCN溶液,再滴加适量新制的氯水 ,充分振荡
若滴加适量新制的氯水后溶液呈红色,则证明有FeO
II、FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O?
FeO+CO↑+CO2↑+2H2O?
不同意,实验没有在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物
本题解析:
Ⅰ(1)根据物质的组成及后面的假设情况可以推知假设一为固体全部是Fe。(2)步骤一:若固体中含有FeO、Fe.则由于金属Fe是比较活泼的金属,能把活动性比它若的金属置换出来。所以可以向固体混合物中加入硫酸铜溶液,充分振荡后静置,若看到溶液的颜色变浅,同时产生暗红色的固体。就证明含有Fe单质。步骤三:将步骤而所得的的固体加入到足量的稀HCl中,发生反应:FeO+2HCl=FeCl2+H2O.充分振荡后静置,取上层清液,滴加几滴KSCN溶液,无现象,再滴加几滴新制的氯水 ,充分振荡,若看到溶液变为血红色,则证明固体中含有FeO.
II 根据质量守恒定律和电子守恒的规律可知FeC2O4·2H2O晶体受热分解的化学方程式为FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O。根据方程式FeC2O4·2H2O
FeO+CO↑+CO2↑+2H2O。根据方程式FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O可知1g晶体FeC2O4·2H2O分解产生的FeO的质量为0.4g.但由于分解反应在坩埚中敞口充分加热,没有在密闭的容器内进行。FeO有还原性,在加热时容易被空气中的氧气氧化为Fe2O3.所以固体的质量总大于0.4g.因此不能由此得到结论说假设二不成立。3+的检验、方程式的书写的知识。
FeO+CO↑+CO2↑+2H2O可知1g晶体FeC2O4·2H2O分解产生的FeO的质量为0.4g.但由于分解反应在坩埚中敞口充分加热,没有在密闭的容器内进行。FeO有还原性,在加热时容易被空气中的氧气氧化为Fe2O3.所以固体的质量总大于0.4g.因此不能由此得到结论说假设二不成立。3+的检验、方程式的书写的知识。
本题难度:一般