微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,将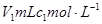 的醋酸滴加到
的醋酸滴加到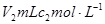 的烧碱溶液中,下列结论正确的是
的烧碱溶液中,下列结论正确的是
A.若混合溶液的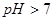 ,则混合溶液中
,则混合溶液中
B.若混合溶液的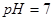 ,则混合溶液中
,则混合溶液中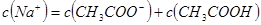
C.若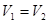 ,且混合溶液
,且混合溶液 ,则必有
,则必有
D.若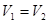 ,
,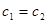 ,则混合溶液中
,则混合溶液中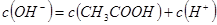
参考答案:D
本题解析:根据电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-)可知,如果pH大于7,则c(Na+)大于c(CH3COO-),A不正确。如果pH=7,则c(Na+)=c(CH3COO-),B不正确。PH小于7,说明溶液显酸性,此时醋酸一定是过量的,所以c1大于c2,C不正确。选项D中二者恰好反应,生成的醋酸钠水解显碱性,根据质子守恒可知,D正确,答案选D。
本题难度:一般
2、选择题 中和相同体积、相同pH的Ba(OH)2、NaOH、NH3·H2O三种溶液,所用相同浓度的盐酸的体积分别是V1、V2、V3,则三者的关系是:(? )
A.V1=V2=V3
B.V1>V2>V3
C.V3>V1>V2
D.V1=V2<V3
参考答案:D
本题解析:酸碱中和时,自由移动的OH-和分子中的OH-都反应;
相同pH的Ba(OH)2、NaOH、NH3·H2O三种溶液,C(自由移动的OH-)相同;
对相同体积、相同pH的Ba(OH)2、NaOH,因为两者都是强碱,所以n总(OH-)相等,则消耗等量的盐酸,即:V1=V2;
对相同体积、相同pH的NH3·H2O,因为它是弱碱,n总(OH-)大于另两者,则消耗的盐酸多,即:V3>V1=V2
本题难度:一般
3、填空题 (10分)常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3?H2O(1)上述溶液中,可发生水解的是?(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的
顺序为?。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值?(填增大、
减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积?④的体积(填
大于、小于、等于)。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=?。
参考答案:⑴①② ⑵ c(Na+)>c(HCO3-)>c(OH -)>c(H+)> c(CO32-) ⑶ 增大 ⑷ < ;⑸10-12mol/L
本题解析:(1)强酸弱碱盐或强碱弱酸盐可发生水解,所以能水解的有:①Na2CO3②NaHCO3;
(2)既能与氢氧化钠反应,又能和硫酸反应的溶液为②NaHCO3,其溶液中离子浓度大到小的顺序为:c(Na+)>c(HCO3-)>c(OH -)>c(H+)> c(CO32-);
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值将增大;
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积小于④的体积;
本题难度:一般
4、选择题 今有如下三个热化学方程式:
H2(g)+1/2O2(g) = H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g) = H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g) = 2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述,正确的是
A.它们都是吸热反应
B.氢气的燃烧热为ΔH=a kJ·mol-1
C.反应热的关系:a=b
D.反应热的关系:2b=c